
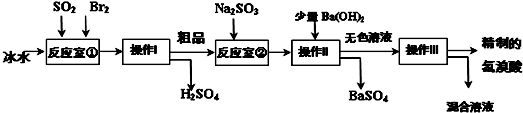
分析 Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,反应室1中发生反应:SO2+Br2+2H2O=H2SO4+2HBr,Br2氧化SO2放出很多热量,液溴、氢溴酸易挥发,反应室①使用冰水降低温度,防止Br2和HBr挥发,操作I是将互溶的硫酸、氢溴酸分离,而氢溴酸易挥发,应采取蒸馏进行分离.粗品中可能含有挥发出的Br2,加入Na2SO3,除去粗品中未反应完的溴,再加入氢氧化钡溶液,使反应生成SO42- 转化硫酸钡沉淀,再进行过滤分离,无色溶液中含有HBr及NaBr,再蒸馏得到精致的氢溴酸.
(5)操作Ⅲ为蒸馏,用到的玻璃仪器有:酒精灯、蒸馏烧瓶、温度计、冷凝器、牛角管、锥形瓶;
(6)①用KSCN溶液检验Fe3+,滴加KSCN溶液,溶液变成血红色;
②由工艺流程可知,溶液中可能含有Br2,可以用CCl4萃取方法检验.
解答 解:Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,反应室1中发生反应:SO2+Br2+2H2O=H2SO4+2HBr,Br2氧化SO2放出很多热量,液溴、氢溴酸易挥发,反应室①使用冰水降低温度,防止Br2和HBr挥发,操作I是将互溶的硫酸、氢溴酸分离,而氢溴酸易挥发,应采取蒸馏进行分离.粗品中可能含有挥发出的Br2,加入Na2SO3,除去粗品中未反应完的溴,再加入氢氧化钡溶液,使反应生成SO42- 转化硫酸钡沉淀,再进行过滤分离,无色溶液中含有HBr及NaBr,再蒸馏得到精致的氢溴酸.
(1)Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,自身被还原为HBr,反应室1中发生反应:SO2+Br2+2H2O=H2SO4+2HBr,
故答案为:SO2+Br2+2H2O=H2SO4+2HBr;
(2)Br2氧化SO2放出很多热量,液溴、氢溴酸易挥发,反应室①使用冰水降低温度,防止Br2和HBr挥发,
故答案为:防止Br2和HBr挥发;
(3)操作I是将互溶的硫酸、氢溴酸分离,而氢溴酸易挥发,应采取蒸馏进行分离;操作Ⅱ分离固体与液体,应是过滤,
故答案为:蒸馏;过滤;
(4)粗品中可能含有挥发出的Br2,加入Na2SO3,还原除去粗品中的Br2,
故答案为:还原除去粗品中的Br2;
(5)操作Ⅲ为蒸馏,用到的玻璃仪器有:酒精灯、蒸馏烧瓶、温度计、冷凝器、牛角管、锥形瓶,
故答案为:酒精灯、蒸馏烧瓶、温度计、冷凝器、牛角管、锥形瓶;
(6)①用KSCN溶液检验Fe3+:取少许溶液滴加KSCN溶液,溶液变成血红色,说明氢溴酸呈淡黄色是因为含Fe3+,
故答案为:KSCN溶液;溶液变成血红色;
②由工艺流程可知,溶液中可能含有Br2,可以用CCl4萃取方法检验:用胶头滴管取制得的氢溴酸于试管中,滴加CCl4、振荡、静止分层,下层呈橙红色,说明氢溴酸呈淡黄色是因为含Br2,
故答案为:氢溴酸中含有Br2;用胶头滴管取制得的氢溴酸于试管中,滴加CCl4、振荡、静止分层,下层呈橙红色,说明氢溴酸呈淡黄色是因为含Br2.
点评 本题以制备氢溴酸为载体,考查学生对工艺流程的理解、物质的分离提纯等基本操作、离子检验、物质性质等,难度中等,是对知识的综合运用,需学生具有扎实的基础知识与灵活运用知识解决问题的能力.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| 实验编号 | T/℃ | NO初始浓度mol•L-1 | CO初始浓度mol•L-1 | 催化剂的比表面积m2•g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
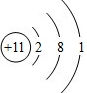 ;A、B两元素形成化合物的名称是氯化钠,用电子式表示该化合物的形成过程
;A、B两元素形成化合物的名称是氯化钠,用电子式表示该化合物的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com