
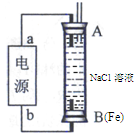
| A.实验①中,反应生成的Mn2+可能是该反应的催化剂 |
| B.实验②中,该反应是太阳能转变为光能 |
| C.实验③中,有气泡产生的棒是铁棒 |
| D.实验④中,加入的水是反应的催化剂,且该反应能自发进行 |
科目:高中化学 来源:不详 题型:单选题
| A.在氧化还原反应中,一种元素被氧化的同时一定有另一种元素被还原 |
| B.在原电池装置中,一定要有两个活泼性不同的金属作为电极材料 |
| C.在化合物中,不是电解质就是非电解质 |
| D.对于可逆反应,温度升高则该反应的平衡常数一定增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2NH3(g) △H < 0 ,其平衡常数K与温度T的关系如下表:
2NH3(g) △H < 0 ,其平衡常数K与温度T的关系如下表:| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
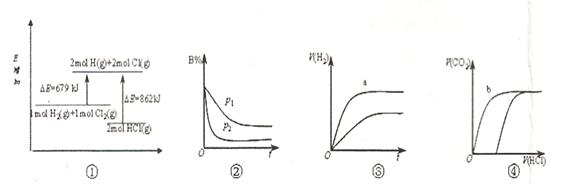
| A.①表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183kJ/mol |
B.②表示其它条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体 |
| C.③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
| D.④表示10mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.lmol/LHCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 的转化率随时间的变化关系如图1所示。
的转化率随时间的变化关系如图1所示。 点速率为V正(CO2)(填“大于”、“小于”或“等于”)
点速率为V正(CO2)(填“大于”、“小于”或“等于”)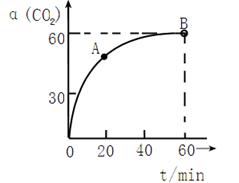
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应C(s)+CO2(g)=2CO(g);△H>0,在任何条件下均不能自发进行 |
| B.铅蓄电池在放电过程中,溶液的PH值增加 |
| C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小 |
| D.温度一定时,水的离子积常数Kw不随外加酸(碱)浓度的改变而改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.反应A(g) 2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1 2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1 |
| B.已知25℃时,有关弱酸的电离平衡常数:HCN Ka=4.9×10-10; H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11。则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3 |
C.已知: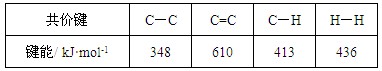 则反应 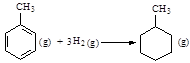 的焓变为ΔH = -384 kJ·mol-1 的焓变为ΔH = -384 kJ·mol-1 |
| D.一定浓度的NaOH溶液,温度升高PH值不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
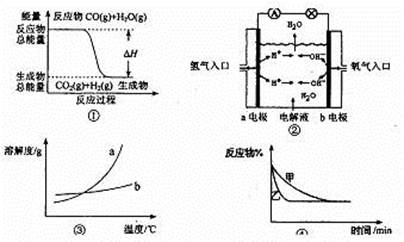
| A.图①表示化学反应中能量的变化,反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H大于0 |
| B.图②为氢氧燃料电池示意图,正、负极通入气体体积之比为2:1 |
| C.图③表示物质a、b的溶解度曲线,可以用结晶方法从a、b混合物中提纯a |
D.图④表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com