
(15分)氮的化合物在无机化工领域有着重要的地位。请回答下列问题:
(1)基态氮原子的价电子排布图为______。氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化轨道类型为 。
(2)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气与氧化铝和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,工业制备X的化学方程式为____。
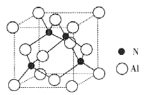
(3)X晶体中包含的化学键类型为______。(填字母标号)
A.离子键 B.共价键 C.配位键 D.金属键
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是______
(5)若X的密度为pg/cm3,则晶体中最近的两个N原子的距离为______cm(阿伏加德罗常数用NA表示,不必化简)。
(1)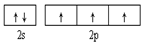 直线 sp (2) Al2O3+N2+3C
直线 sp (2) Al2O3+N2+3C 2AlN+3CO (3)B、C
2AlN+3CO (3)B、C
(4)氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B—N键键能大于Al—N键键能 (5)
【解析】
试题分析:(1)7号元素N的核外电子排布式是1s22s22p3,所以基态氮原子的价电子排布图为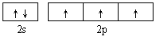 ;氮的最高价氧化物N2O5为无色晶体,它由两种离子构成:NO2+(硝酰阳离子)和NO3-(硝酸根离子),其中阳离子呈直线型,阳离子中氮的杂化轨道类型为sp杂化,阴离子构型为平面正三角形; (2) 工业制备X的化学方程式为Al2O3+N2+3C
;氮的最高价氧化物N2O5为无色晶体,它由两种离子构成:NO2+(硝酰阳离子)和NO3-(硝酸根离子),其中阳离子呈直线型,阳离子中氮的杂化轨道类型为sp杂化,阴离子构型为平面正三角形; (2) 工业制备X的化学方程式为Al2O3+N2+3C 2AlN+3CO;(3)在AlN晶体中包含的化学键类型为共价键、配位键。因此选项为B、C。(4)已知氮化硼与AlN晶体类型相同,且氮化硼的熔点比AlN高,可能的原因是氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,使得B—N键的键能大于Al—N键的键能。(5)在每个晶胞中含有的Al原子的个数为:8×1/8+6×1/2=4;N:1×4=4.因此含有4个AlN。设晶胞的变成为L,则
2AlN+3CO;(3)在AlN晶体中包含的化学键类型为共价键、配位键。因此选项为B、C。(4)已知氮化硼与AlN晶体类型相同,且氮化硼的熔点比AlN高,可能的原因是氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,使得B—N键的键能大于Al—N键的键能。(5)在每个晶胞中含有的Al原子的个数为:8×1/8+6×1/2=4;N:1×4=4.因此含有4个AlN。设晶胞的变成为L,则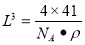 ;
;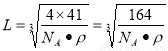 则晶体中最近的两个N原子的距离为
则晶体中最近的两个N原子的距离为 cm。在晶胞中每个Al原子结合4个N原子,每个N原子结合4个Al原子,2个Al原子之间的距离与2个N原子的距离相等,都等于面对角线的一半,所以2个N原子之间的距离等于
cm。在晶胞中每个Al原子结合4个N原子,每个N原子结合4个Al原子,2个Al原子之间的距离与2个N原子的距离相等,都等于面对角线的一半,所以2个N原子之间的距离等于 。
。
考点:考查原子的价电子排布图、原子的杂化方式、晶体的结构、物质含有的化学键、原子晶体中微粒的距离的计算、及物质的性质的差异的原因等知识。


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:选择题
键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量。现查得:H-H、Cl-Cl和H-Cl的键能分别为436kJ/mol、243kJ/mol和431kJ/mol,请用此数据估计,由Cl2、H2生成1molHCl时的热效应为( )
A.放热91.5kJ B.放热183kJ C.吸热183kJ D.吸热91.5kJ
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省6月高二化学期末测试卷(解析版) 题型:选择题
某有机物的结构简式如图所示,其名称正确的是

A.5-乙基-2-己烯 B.3-甲基庚烯
C.3-甲基-5-庚烯 D.5-甲基-2-庚烯
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:填空题
(15分)某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:


(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4; CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2 + C6  CoO2 + LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2 + LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:选择题
元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素(图中字母不表示元素符号)。下列说法正确的是
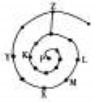
A.L、M、X三元素位于同一族
B.K、Z两元素的氢化物的水溶液都显酸性
C.Y元素对应的氢化物比K元素对应的氢化物沸点低
D.K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3-
查看答案和解析>>
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、Z同周期。X和Y能形成两种常见共价化合物,Z能与X形成两种常见的离子化合物,阴、阳离子个数比均为1:2。下列说法错误的是
A.Y、Z、X、W的原子序数依次减小
B.X的简单氢化物的沸点低于Y的简单氢化物的沸点
C.由W、X、Y、Z四种元素组成的化合物可能显强酸性
D.W和X形成的化合物,与W和Y形成的化合物中各元素质量比可能相同
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省青岛市高三第二次模拟考试理综化学试卷(解析版) 题型:推断题
(12分)【化学——有机化学基础】
某研究小组以甲苯为主要原料,合成医药中间体F和Z。
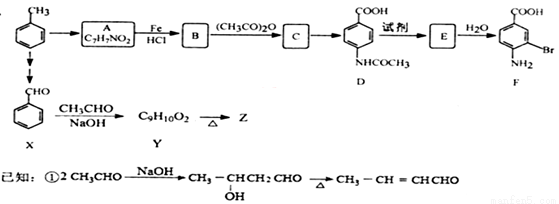
②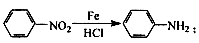 苯胺中氨基易被氧化。
苯胺中氨基易被氧化。
请回答下列问题:
(1)有机物A的结构简式为 。
(2)下列有关F的说法正确的是 。
a.分子式是C7H7NO2Br b.能形成内盐
c.能发生酯化反应和缩聚反应 d.1 mol的F最多可以和2 mol NaOH反应
(3)B→C的化学方程式是 。在合成F的过程中,B→C步骤不能省略,理由是 。
(4)写出同时符合下列条件的Z的同分异构体(不含Z,不考虑立体异构)。
①含有苯环结构 ②与Z含有相同官能团
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省烟台市高三5月适应性测试一理综化学试卷(解析版) 题型:填空题
(18分)能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2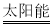 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2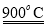 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应是 ,该反应将太阳能转化为 。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为 。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O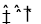 HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。
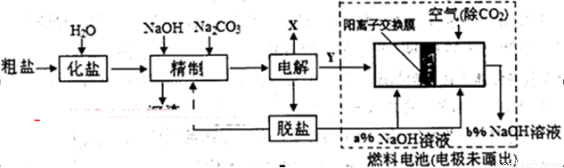
①电解过程中发生反应的离子方程式是 ,阴极附近溶液PH (填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的 。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式 。
③图中氢氧化钠溶液的质量分数a% b%(填“>”、‘‘=”或“<”),,燃料电池中负极上发生的电极反应为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列叙述错误的是
A.乙烯和苯都能使溴水褪色,褪色的原理相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
D.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com