
【题目】某班学生通过分组实验测定酸碱滴定曲线。
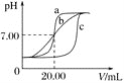
实验用品:0.1 mol·L-1HCl溶液、0.1 mol·L-1NaOH溶液、蒸馏水、pH计、酸式滴定管、碱式滴定管、铁架台(带滴定管夹)、锥形瓶。甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00 mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,其中乙和丙两组同学的操作上都存在着不足或失误。
请回答下列问题:
(1)实验前pH计应用标准溶液进行校准,若将pH计放入c(H+)=0.0001 mol·L-1的标准溶液中校准,则pH计的读数应为________。
(2)甲组同学滴定时选用的滴定管为________(填“酸式”或“碱式”)滴定管,最后一次润洗滴定管应选用实验用品中的________进行润洗。
(3)乙组同学操作上的不足之处是________________________________________。
(4)造成丙组同学的曲线与甲组同学不同的原因可能是________(填字母)。
A.用待装液润洗锥形瓶
B.滴定使用的滴定管的尖嘴部分在滴定前有气泡未排出,滴定后气泡消失
C.滴定前后对滴定管进行读数的视线分别如图所示

【答案】4.00 碱式 0.1 mol·L-1NaOH溶液 在滴定终点附近测试和记录pH的间隔太大 AB
【解析】
(1)一般来说,pH计的读数可以精确到小数点后2位,pH=-lgc(H+)=-lg 0.0001=4.00。故答案为:4.00;
(2)图象分析,随加入溶液反应,溶液pH增大,甲同学所进行的实验为用0.1 mol·L-1NaOH溶液滴定20.00 mL的0.1 mol·L-1HCl溶液,故所用的滴定管应为碱式滴定管,最后一次润洗时要使用0.1 mol·L-1NaOH溶液。故答案为:碱式;0.1 mol·L-1NaOH溶液;
(3)b曲线没有像曲线a那样,有非常明显的突变过程,是由于在滴定终点附近pH的测定时,pH间隔过大,取得数据较少;故答案为:在滴定终点附近测试和记录pH的间隔太大 ;
(4)滴定至终点时丙所用体积NaOH比甲、乙多,
A、用待测液润洗锥形瓶,HCl偏多,消耗的NaOH也偏多,A符合题意;
B、滴定前有气泡未排出,滴定后气泡消失,造成记录的NaOH的体积偏大,B符合题意;
C、滴定前仰视,滴定后俯视,会使测得的NaOH溶液体积较少,C不符合题意;
故答案为:AB。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
B.0.5molC3H8分子中所含C-H共价键数为2NA
C.标准状况下,22.4 L CHCl3中含有的氯原子数目为3NA
D.标准状况下,22.4L乙醇完全燃烧所耗的氧气分子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是
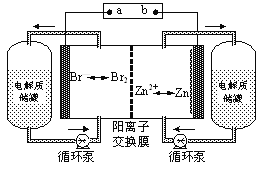
A.充电时电极a连接电源的负极
B.放电时负极的电极反应式为Zn—2e-=Zn2+
C.放电时左侧电解质储罐中的离子总浓度增大
D.阳离子交换膜可阻止Br2与Zn直接发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
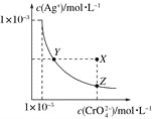
A.t℃时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(如图所示)可用于制备各种高性能防腐蚀涂料。W、X、Y、Z是原子序数依次增大的短周期主族元素,且占据三个不同周期,W与Z的质子数之和是X的2倍。下列说法不正确的是
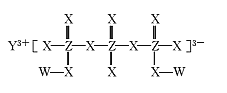
A.原子半径:Y>Z>X
B.X元素的族序数是Y元素的2倍
C.工业上电解熔融Y2X3化合物制备单质Y
D.W与X形成的所有化合物都只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置研究原电池原理。下列叙述错误的是
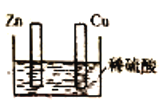
A.Cu棒和Zn棒用导线连接时,铜片上有气泡逸出
B.Cu棒和Zn棒不连接时,锌片上有气泡逸出
C.无论Cu棒和Zn棒是否用导线连接,装置中所涉及的总反应都相同
D.无论Cu棒和Zn棒是否用导线连接,装置都是把化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1 mol丙酮酸![]() 在镍催化剂作用下加1 mol氢气转化变成乳酸。乳酸的结构简式为_________________________________________。
在镍催化剂作用下加1 mol氢气转化变成乳酸。乳酸的结构简式为_________________________________________。
(2)与乳酸具有相同官能团的乳酸的同分异构体A在酸性条件下,加热失水生成B,由A生成B的化学反应方程式是_________________________________
(3)B的甲酯可以聚合,聚合物的结构简式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置(如图)。
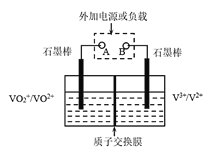
已知:
①溶液呈酸性且阴离子为SO42-;
②溶液中颜色:V3+绿色,V2+紫色,VO2+黄色,VO2+蓝色;
③放电过程中,右槽溶液的颜色由紫色变成绿色。
下列说法不正确的是
A.放电时B极为负极
B.放电时若转移的电子数为3.01×1023个,则左槽中H+增加0.5 mol
C.充电过程中左槽的电极反应式为:VO2++H2O-e- =VO2++2H+
D.充电过程中H+通过质子交换膜向右槽移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近的研究发现,复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,因而受到许多发达国家的青睐。MnFe2O4的制备流程如下:

(1)原料Fe(NO3)n中n=______,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为______。
(2)步骤二中“连续搅拌”的目的是______;步骤三中洗涤干净的标准是______。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:MnFe2O4![]() MnFe2O4﹣x+
MnFe2O4﹣x+![]() O2↑、MnFe2O4﹣x+xH2O→MnFe2O4+xH2↑。请认真分析上述两个反应并回答下列问题:
O2↑、MnFe2O4﹣x+xH2O→MnFe2O4+xH2↑。请认真分析上述两个反应并回答下列问题:
①若MnFe2O4﹣x中x=0.6,则MnFe2O4﹣x中Fe2+占全部铁元素的百分率为______。
②该热化学循环制氢法的优点有______(答两点即可)。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com