
 ,很多不饱和有机物在E催化下可与H2加成反应:
,很多不饱和有机物在E催化下可与H2加成反应: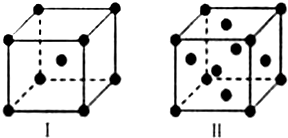
分析 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni,据此解答.
(1)金属性越强,其第一电离能最小,非金属性越强电负性越大;
(2)黄血盐的化学式K4[Fe(CN)6],CN-与氮气互为等电子体,CN-中存在C≡N三键,黄血盐晶体中含有离子键、配位键、共价键;
(3)Ni2+的价层电子排布式为3d8,据此书写价电子排布图;
确定C原子价层电子对数、孤电子对,判断C原子杂化方式、HCHO分子的立体结构,甲醛与氢气的加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的高;
(4)金属K晶体为体心立方堆积,晶胞结构为图Ⅰ,晶胞中K原子配位数为8,金属Cu晶体为面心立方最密堆积,晶胞结构为图Ⅱ,以顶点Cu原子研究与之最近的原子位于面心,每个顶点Cu原子为12个面共用,晶胞中Cu原子配位数为12;
利用均摊法计算金属K的晶胞中K原子数目,进而计算晶胞质量,根据V=$\frac{m}{ρ}$计算晶胞体积,可得晶胞棱长,设K原子半径为r,则晶胞体对角线长度=4r,利用体对角线与棱长关系列方程计算解答.
解答 解:前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni,
(1)六种元素中K的金属性最强,其第一电离能最小,非金属性越强电负性越大,故电负性最大的是N,
故答案为:K;N;
(2)黄血盐的化学式K4[Fe(CN)6],CN-与氮气互为等电子体,CN-中存在C≡N三键,故1mol CN-中含有π键的数目为2NA,黄血盐晶体中含有离子键、配位键、共价键,没有金属键、氢键、分子间的作用力,
故答案为:K4[Fe(CN)6];2NA;def;
(3)Ni2+的价层电子排布式为3d8,故价电子排布图为
①CH2=CH2、③
故答案为:
(4)金属K晶体为体心立方堆积,晶胞结构为图Ⅰ,晶胞中K原子配位数为8,金属Cu晶体为面心立方最密堆积,晶胞结构为图Ⅱ,以顶点Cu原子研究与之最近的原子位于面心,每个顶点Cu原子为12个面共用,晶胞中Cu原子配位数为12,K、Cu两种晶体晶胞中金属原子的配位数之比为 8:12=2:3;
金属K的晶胞中,K原子数目=1+8×$\frac{1}{8}$=2,若K原子的摩尔质量为M,阿伏加得罗常数为NA,则晶胞质量=$\frac{2M}{{N}_{A}}$g,设该晶胞的密度为a g/cm3,则晶胞体积=$\frac{\frac{2M}{{N}_{A}}g}{ag/c{m}^{3}}$=$\frac{2M}{a{N}_{A}}$cm3,晶胞棱长=$\root{3}{\frac{2M}{a{N}_{A}}}$cm,设K原子半径为r,则晶胞体对角线长度=4r,故3($\root{3}{\frac{2M}{a{N}_{A}}}$cm)2=(4r)2,故r=$\frac{\sqrt{3}}{4}\root{3}{\frac{2M}{a{N}_{A}}}$cm,
故答案为:2:3;$\frac{\sqrt{3}}{4}\root{3}{\frac{2M}{a{N}_{A}}}$cm.
点评 本题是对物质结构的考查,涉及元素推断、核外电子排布、电离能、电负性、配合物、化学键、杂化轨道、晶胞计算等,(4)为易错点、难点,需要学生熟记晶胞结构,对学生的空间想象及数学计算具有一定的要求,难点中等.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=11的氨水与pH=3的硫酸各1L混合后,C(NH4+)>2c(SO42-) | |
| C. | pH=11的氨水与pH=11的醋酸钠溶液,由水电离出的c(H+)相等 | |
| D. | pH相同的①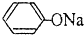 溶液②CH3COONa溶液中的c(Na+):①>② 溶液②CH3COONa溶液中的c(Na+):①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
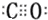 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): ;D
;D .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
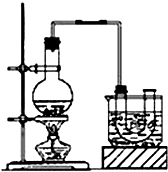 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4g | B. | 6g | C. | 12.4g | D. | 8.8g |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:填空题
I.某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
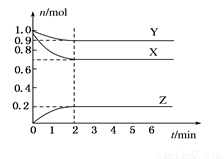
(1)该反应的化学方程式为_______________________。
(2)反应开始至2 min,气体Z的平均反应速率为____________。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的____________倍;
②若此时将容器的体积缩小为原来的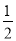 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为____________反应(填“放热”或“吸热”)。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为____________反应(填“放热”或“吸热”)。
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应:4NO2(g)+O2(g) 2N2O5(g) ΔH<0的影响。
2N2O5(g) ΔH<0的影响。

(1)图像中T1和T2的关系是T1________T2(填“>”、“<”或“=”);
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是__________(填字母);
(3)若容器体积为1 L,n=1 mol,NO2的转化率为50%,则此条件下(T2),反应的平衡常数K=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com