
【题目】硼、砷、锑的化合物用途非常广泛。回答下列问题:
(1)基态砷原子的价电子轨道表达式(电子排布图)为_______________,其未成对电子所在原子的轨道轮廓图形为____________________。
(2)B4C的熔点为2350 ℃、沸点为3500 ℃,说明它属于____________晶体,AsF3的沸点(60.4℃)比SbF3的沸点(376℃)低,其原因是____________________________________。
(3)已知反应:(CH3)3C—F+SbF6→(CH3)3CSbF6,该反应可生成(CH3)3C+,其碳正离子中碳原子杂化方式有____________________________________。
(4)与BF3互为等电子体的分子和离子分别为_______________(各举1例);已知分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则BF3中的大π键应表示为_________________。
),则BF3中的大π键应表示为_________________。
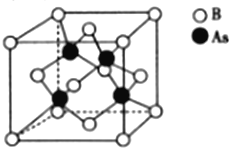
(5)砷化硼的晶胞结构如图所示。与砷原子紧邻的硼原子有_________个,与每个硼原子紧邻的硼原子有_________个,若其晶胞参数为bpm,则其晶体的密度为_________________(列出表达式,设NA为阿伏加德罗常数的数值)g·cm-3。
【答案】 ![]() 哑铃型(纺锤形) 原子 AsF3 与SbF3 是结构相似的分子,AsF3 相对分子质量比SbF3 小 sp2和sp3 SO3 和CO32-(或其他合理答案)
哑铃型(纺锤形) 原子 AsF3 与SbF3 是结构相似的分子,AsF3 相对分子质量比SbF3 小 sp2和sp3 SO3 和CO32-(或其他合理答案) ![]() 4 12 【答题空10】
4 12 【答题空10】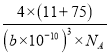
【解析】(1)As为第四周期第ⅤA族元素,所以原子核外价电子排布式为4s24p3,4p轨道中有3个电子,且都是单电子,其价电子轨道排布图为:![]() ;其未成对电子所在原子的轨道为4p轨道,轨道轮廓图形为哑铃型(纺锤形)。
;其未成对电子所在原子的轨道为4p轨道,轨道轮廓图形为哑铃型(纺锤形)。
(2)B4C由两种非金属元素组成,不可能为离子晶体,又因为其熔沸点很高,所以应属于原子晶体;AsF3和SbF3的沸点都比较低,都是由分子构成的,并且结构相似,AsF3相对分子质量比SbF3小,所以AsF3的沸点比SbF3的沸点低。
(3)(CH3)3C+中,甲基上的C原子形成4条单键,属于sp3杂化,中心C原子形成3条单键,价电子层仅有六个电子,无孤对电子,属于sp2杂化。
(4)等电子体是指具有相同价电子数目和原子数目的分子或离子,所以与BF3互为等电子体的分子可以是SO3、BCl3等,与BF3互为等电子体的离子可以是CO32-、NO3-等;因为大π键的符号![]() 中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),又因为BF3中参与形成大π键的原子数为4,形成大π键的电子数为6,所以BF3中的大π键表示为:
),又因为BF3中参与形成大π键的原子数为4,形成大π键的电子数为6,所以BF3中的大π键表示为: ![]() 。
。
(5)根据晶胞结构图可以判断,砷原子(黑球)与周围4个硼原子(白球)形成单键,则与砷原子紧邻的硼原子有4个。根据晶胞结构图,设棱长为b,以立方体上面面心的硼原子(白球)为例分析,该硼原子与除了对面上的5个硼原子之外的其他8个硼原子紧邻,距离都是![]() b;又因为该硼原子属于上下相邻两个晶胞共有(上方的晶胞未画出),同理,该硼原子还与其上方的立方体中除对面外的其他四个面面心上的硼原子紧邻,距离都是
b;又因为该硼原子属于上下相邻两个晶胞共有(上方的晶胞未画出),同理,该硼原子还与其上方的立方体中除对面外的其他四个面面心上的硼原子紧邻,距离都是![]() b,综上分析,与每个硼原子紧邻的硼原子共有12个。由均摊法计算晶胞原子数:4个砷原子(黑球)都在晶胞内部,故砷原子数为4,硼原子有8个在顶点、6个在面心,故硼原子数为8×
b,综上分析,与每个硼原子紧邻的硼原子共有12个。由均摊法计算晶胞原子数:4个砷原子(黑球)都在晶胞内部,故砷原子数为4,硼原子有8个在顶点、6个在面心,故硼原子数为8×![]() +6×
+6×![]() =4个,所以晶胞质量为:
=4个,所以晶胞质量为: ![]() g,因为bpm=b×10-10cm,所以晶胞体积为:(b×10-10)3cm3,根据密度=质量÷体积,所以晶胞密度为:
g,因为bpm=b×10-10cm,所以晶胞体积为:(b×10-10)3cm3,根据密度=质量÷体积,所以晶胞密度为: 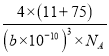 g·cm-3。
g·cm-3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化合物A是一种不稳定的物质,它的分子组成可用OxFy表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下)。
(1)A的化学式是____________________________________________________________。
(2)已知A分子中x个氧原子呈…O—O—O…链状排列,则A分子的电子式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物用途非常广泛,已知铅(Pb)与硅同主族且Pb比Si多3个电子层。回答下列问题:
(1)铅位于元素周期表的第__________周期__________族。
(2)难溶物PbSO4溶于CH3COONH4溶液可制得(CH3COO)2Pb [(CH3COO)2Pb易溶于水],发生的反应为 PbSO4+2CH3COONH4=(CH3COO)2Pb +(NH4)2SO4,说明(CH3COO)2Pb是_______(填“强”或“弱”)电解质。
(3)铅蓄电池充放电原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,其中工作“B”为________(填“放电”或“充电”);电解质不能用浓盐酸,否则电池失效并放出大量的氯气,其原因是________(用化学方程式表示)。
2PbSO4+2H2O,其中工作“B”为________(填“放电”或“充电”);电解质不能用浓盐酸,否则电池失效并放出大量的氯气,其原因是________(用化学方程式表示)。
(4)将PbO2加入硝酸酸化的Mn(NO3)2溶液中,揽拌后溶液显紫红色。则每反应1 molMn(NO3)2,转移______________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关0.1mol/LNH3·H2O溶液中,下列说法中正确的是( )
A.氨水电离方程式为:NH3·H2O=NH4++OH-
B.溶液中有:c(NH4+)+c(H+)=c(OH-)
C.溶液中:c(NH3·H2O)=0.1mol/L
D.加入少量NaOH固体,溶液中碱性增强,c(H+)·c(OH-)的乘积将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 碳酸钠溶液和碳酸氢钠溶液都能与澄清石灰水反应产生沉淀
B. 二氧化硫能使酸性高锰酸钾溶液紫红色褪去
C. 实验室能用二氧化锰和稀盐酸共热制氯气
D. 常温下铝片不能溶于浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图1为甲烷和O2构成的燃料电池示意图,电解质溶液为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是
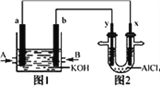
A. 图2中Y电极为阴极
B. 图2中总反应的化学方程式为:2AlCl3+6H2O2![]() 2Al(OH)3↓+3Cl2↑+3H2↑
2Al(OH)3↓+3Cl2↑+3H2↑
C. 图1中电解质溶液的pH增大
D. 图1中的a 电极反应式为:CH4-8e-+8OH-=CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列溶液一段时间后再加入一定量的某种物质(方括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
A. AgNO3 [AgNO3] B. NaOH [H2O]
C. KCl [KCl] D. CuSO4 [Cu(OH)2]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com