
��8�֣�����Ũ�Ⱦ�Ϊ0.1 mol/L��������Һ�������� �ڴ��� ���������� ���Ȼ�梨������� ��̼�����ơ���ش��������⣺
(1)�٢ڢۢ�������Һ����ˮ�������H��Ũ���ɴ�С��˳���� ������ţ���
(2)��֪T�棬��ˮ��c(H+)=1��10-6.5 mol��L-1����T�� �������������������������25�档��T��ʱ����pH = 11�Ģ���Һa L��pH = 1�Ģ���Һb L��ϣ����Ի�Ϻ���Һ����ı仯������������Һ��pH = 10����a��b = ��
(3)������Һ�͢���Һ���ʱ���ɿ�����ʵ�������� ,�����������ԭ���� �������ӷ���ʽ����ԭ��
(1) �ܣ��ڣ��ۣ��� ��(2) T�� �� a��b ��101 : 9 ��
(3) ������ɫ����ͬʱ������ɫ���� ��Al3+ +3HCO3�� ==3CO2�� +Al(OH)3��
����������1�������е������ӻ�OH��Ũ��Խ��ˮ������Խ���Ȼ��ˮ��ٽ�ˮ�ĵ��룬���Ԣ٢ڢۢ�������Һ����ˮ�������H��Ũ���ɴ�С��˳��Ӧ���Ǣܣ��ڣ��ۣ��١�
��2���������ȣ����ȴٽ�ˮ�ĵ��룬������Ũ���������T�棾25�档������Һ��pH = 10�������������ǹ����ģ���Ӧ����Һ��������Ũ��10��10mol/L����OH��Ũ����10��13��10��10��0.001mol/L������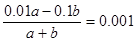 �����a��b ��101 : 9��
�����a��b ��101 : 9��
��3��������ˮ�������ԣ�̼������ˮ���Լ��ԣ����Զ���Ϻ�ˮ����ٽ���������������������CO2���壬����ʽΪAl3+ +3HCO3�� ==3CO2�� +Al(OH)3����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ������м���һ�и߶��������¿���ѧ�Ծ����������� ���ͣ������
��8�֣�����Ũ�Ⱦ�Ϊ0.1 mol/L��������Һ�������� �ڴ��� ���������� ���Ȼ�梨������� ��̼�����ơ���ش��������⣺
(1)�٢ڢۢ�������Һ����ˮ�������H��Ũ���ɴ�С��˳���� ������ţ���
(2)��֪T�棬��ˮ��c(H+)=1��10-6.5 mol��L-1����T�� �������������������������25�档��T��ʱ����pH = 11�Ģ���Һa L��pH = 1�Ģ���Һb L��ϣ����Ի�Ϻ���Һ����ı仯������������Һ��pH = 10����a��b = ��
(3)������Һ�͢���Һ���ʱ���ɿ�����ʵ�������� ,�����������ԭ���� �������ӷ���ʽ����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�����ʡ�߶���ѧ�����п������⻯ѧ ���ͣ������
��10�֣�����Ũ�Ⱦ�Ϊ0.1 mol/L��������Һ�������ᡢ�ڴ��ᡢ���������ơ����Ȼ�李��ݴ���李�������李���������泥��ఱˮ����ش��������⣺
��1���١��ڡ��ۡ���������Һ����ˮ�������H+Ũ���ɴ�С��˳���ǣ�����ţ�________��
��2���ܡ��ݡ��ޡ��ߡ���������Һ��NH4+Ũ���ɴ�С��˳���ǣ�����ţ�_________��
��3�����ۺܵ͢������Ϻ��Һ�и�����Ũ���ɴ�С��˳����___________��
��4����֪t�棬KW��1��10��13����t�棨�>����<��������________25�档��t��ʱ��pH��11��NaOH��Һa L��pH��1��H2SO4����Һb L��ϣ����Ի�Ϻ���Һ����ı仯���������û����Һ��pH��2����a��b�� ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
(4��) ����Ũ�Ⱦ�Ϊ0.1 mol/L��������Һ�������ᡢ�ڴ��ᡢ���������ơ����Ȼ�李��ݴ���李�������李���������泥��ఱˮ����ش��������⣺
��1���١��ڡ��ۡ���������Һ����ˮ�������H+Ũ���ɴ�С��˳���ǣ�����ţ�
��
��2���ܡ��ݡ��ޡ��ߡ���������Һ��NH4+Ũ���ɴ�С��˳���ǣ�����ţ�
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��ӱ�ʡ�߶���ѧ�ڵ�һ���¿���ѧ�Ծ� ���ͣ������
(6��)����Ũ�Ⱦ�Ϊ0.1 mol/L��������Һ�������ᡢ�ڴ��ᡢ���������ơ����Ȼ�李��ݴ���李�������李���������李��ఱˮ����ش��������⣺
(1)�١��ڡ��ۡ���������Һ��ˮ�������H��Ũ���ɴ�С��˳����(�����)_________
(2)�ܡ��ݡ��ߡ���������Һ��NH4+Ũ���ɴ�С��˳����(�����)________
(3)���ٺ͢�������Ϻ��Һ�и�����Ũ�ȹ�ϵ��ȷ����________
A��c(H��)��c(SO42��)��c(NH4+)��c(OH��) B��c(H��)��c(SO42��)��c(NH4+)��c(OH��)
C��c(NH4+)��c(H��)��c(SO42��)��c(OH��) D��c(OH��)��c(H��)��c(NH4+)��c(SO42��)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com