
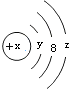
| A. | Y=2 | B. | 若X=14,它的氢化物的化学式为H2X | ||
| C. | 若X=18,则Z=8 | D. | 若X=17,它的氧化物化学式为W2O7 |
分析 A.第一电子层容纳2个电子,故Y=2;
B.若X=14,则W为Si元素,最低负价为-4;
C.若X=18,则为Ar元素;
D.若X=17,则为Cl元素,最高正化合价为+7,据此书写化学式.
解答 解:A.微粒有3个电子层,第一电子层填充满电子,第一电子层容纳2个电子,故Y=2,故A正确;
B.若X=14,则W为Si元素,其氢化物的化学式为SiH4,故B错误;
C.若X=18,则为Ar元素,则Z=8,故C正确;
D.若X=14,则为Cl元素,最高正化合价为+7,最高价氧化物的化学式为Cl2O7,故D正确;
故选B.
点评 本题考查核外电子排布规律、微粒中质子数与电子数关系、结构位置性质关系等,题目难度不大,注意W粒子可能是阴离子、阳离子或中性原子.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①③④ | C. | ①②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥⑦⑧ | B. | ②④⑤⑥⑧ | C. | ②④⑤⑥⑦ | D. | ③④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定互为同分异构体 | |
| B. | 分子式为CnH2n的化合物,可能使酸性KMnO4溶液褪色,也可能不使其褪色 | |
| C. | 通式相同,分子组成上相差一个或若干个CH2原子团的化合物,一定互为同系物 | |
| D. | 凡含有苯环的物质都是芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油经过分馏及裂化等方法得到的物质均为纯净物 | |
| B. | 乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应 | |
| C. | 化合物 是苯的同系物 是苯的同系物 | |
| D. | 地沟油和矿物油可通过加足量的氢氧化钠溶液加热后的不同现象加以区别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中不含离子键 | |
| B. | 凡是金属元素跟非金属元素化合形成离子化合物 | |
| C. | 离子化合物中的阳离子都是金属离子 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com