
【题目】二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。
完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。

如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置
是________(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3,36L(标准状况)二氧化硫,至少需要称取亚硫酸钠______g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠______g (保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图:

碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
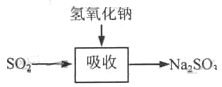
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是____________________。和碱法相比,石灰-石膏法的优点是________________,缺点是________________。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)________________。
【答案】ae 18.9 19.8 酸性氧化物与碱的反应 成本低 亚硫酸钙在输送中容易造成管道堵塞 
【解析】
(1)用硫酸和亚硫酸钠制取二氧化硫,反应物是固液混合,且该反应不需要加热,所以可以采用固液混合不加热型装置,希望能控制反应速度,则盛放硫酸的仪器必须含有活塞而能控制液体量;
(2)由硫守恒可得:Na2SO3~SO2,根据关系式及二氧化硫的物质的量计算出需要亚硫酸钠的质量;设没有变质的亚硫酸钠为100g,根据变质的质量计算出变质后溶液中亚硫酸钠的质量分数,再计算出需要变质后的亚硫酸钠的质量;
(3)根据石灰-石膏法和碱法吸收二氧化硫的原理分析相同之处;利用题中已知信息及反应原理判断石灰-石膏法的优点和缺点;
(4)将亚硫酸钠和氢氧化钙发生复分解反应生成NaOH,然后再将亚硫钙氧化得到二水硫酸钙,这样NaOH能循环利用。
(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的;
(2) H2SO4+Na2SO3=Na2SO4+SO2+H2O
126g 22.4L
m 3.36L
m=18.9g
4g亚硫酸钠被氧化为硫酸钠后的质量变为4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中,亚硫酸钠的质量分数为95.5%,因此称取样品的质量为19.8g。
(3)石灰-石膏法与碱法吸收SO2都是利用SO2是酸性氧化物可与碱反应的性质来吸收SO2的;利用题中已知和有关信息可知采用石灰-石膏法所用原料易得、成本低等,但因Ca(OH)2碱性弱,导致吸收速率慢、效率低;
(4)依据上述流程操作存在的缺点,能实现物料循环的烟气脱硫方案



科目:高中化学 来源: 题型:
【题目】(1)下列方法中可以证明 2HI(g) ![]() H2(g)+I2(g)已达平衡状态的是_________。
H2(g)+I2(g)已达平衡状态的是_________。
①单位时间内生成 n mol H2 的同时生成 n mol HI;
②一个 H—H 键断裂的同时有一个 H—I键断裂;
③百分组成ω(HI)=ω(I2);
④反应速率v(H2)=v(I2)= ![]() v(HI)时;
v(HI)时;
⑤c(HI):c(H2):c(I2)=2:1:1 时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均相对分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化;
(2)对于合成氨上述能说明达到平衡状态的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
CH3OH(g)+H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
A. 容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1 ∶1
B. v正(CO2)=v逆(H2O)
C. 容器内混合气体密度保持不变
D. 3molH-H键断裂同时生成3molH-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
A.CO2的平衡转化率α=2.5%
B.0~4 min内用H2S表示该反应的速率为0.001 mol·L1·min1
C.上述条件下反应达到平衡时放出的热量为0.01Q kJ
D.其他条件不变,若该反应在温度为T2条件下进行,达到平衡所需时间小于4 min,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(用NOx表示)是大气污染的重要因素,根据NOx的来源和性质特点,已开发出多种化学治理其污染的方法。
(1)汽车尾气中的NO2是城市大气污染的主要污染物之一。在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2→2NO+2O,②2NO+O2→2NO2,③O+O2→O3。下列关于该反应过程及生成物的叙述正确的是____(填序号)。
A.NO2起催化作用
B.NO起催化作用
C.NO2只起氧化作用
D.O3与O2互为同素异形体
(2)汽车尾气中的CO来自于____,NO来自于____。
(3)汽车尾气中的CO、NOx可在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:_____。
(4)工业尾气中氮氧化物常采用碱液吸收法处理。NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,该反应的离子方程式为____;1molNO2被完全吸收时,转移电子的物质的量为____。NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容的密闭容器中存在化学平衡:H2(g)+I2(g) ![]() 2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
A. 0.16molL-1 B. 0.08 molL-1 C. 0.04 molL-1 D. 0.02molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 对于平衡体系:mA(g)+ nB(g)![]() pC(g)+ qD(g),下列判断正确的是( )
pC(g)+ qD(g),下列判断正确的是( )
A.若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.45 倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△ H<0
D.若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,某二元酸(简写为
为阿伏加德罗常数的值,某二元酸(简写为![]() )溶液按下式电离:
)溶液按下式电离:![]() ,
,![]() ,关于常温下的下列溶液叙述错误的是( )
,关于常温下的下列溶液叙述错误的是( )
A.![]()
![]() 的
的![]() 溶液的
溶液的![]() 数目为
数目为![]()
B.在![]() 质量分数为46%的
质量分数为46%的![]() 水溶液中,含氧原子总数为
水溶液中,含氧原子总数为![]()
C.![]()
![]() 的
的![]() 溶液中
溶液中![]() 、
、![]() 、
、![]() 、
、![]() 总的粒子数为
总的粒子数为![]()
D.![]() 溶液中一定存在
溶液中一定存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硫酸和木炭粉在加热条件下反应:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,根据如图回答问题:
CO2↑+2SO2↑+2H2O,根据如图回答问题:

(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气?__。
(2)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
①A中加入的试剂是___,作用是___;
②B中加入的试剂是___,作用是___;
③C中加入的试剂是___,作用是___;
④D中加入的试剂是___,作用是___。
(3)实验时,C中应观察到的现象是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com