
 的名称为2,3-二乙基-1-戊烯.
的名称为2,3-二乙基-1-戊烯.分析 (1)根据结构简式来寻找有机物中的官能团;
(2)该有机物为烯烃,含有碳碳双键的最长碳链含有5个C,则主链为戊烯,编号从左边开始,碳碳双键在1、2号C,在2号C、3号C上各含有1个乙基,据此写出其名称;
(3)甲烷燃料电池中,负极上投放燃料甲烷,发生失电子发生氧化反应,注意电解质环境决定方程式的书写.
解答 解:(1)根据该有机物的结构简式,知道该有机物中的官能团有碳碳双键、羧基、羟基,含氧官能团只有羧基、羟基,
故答案为:羧基、羟基;
(2)该有机物为烯烃,含有碳碳双键的最长碳链含有5个C,则主链为戊烯,编号从左边开始,碳碳双键在1、2号C,在2号C、3号C上各含有1个乙基,该有机物名称为:2,3-二乙基-1-戊烯,
故答案为:2,3-二乙基-1-戊烯;
(3)电解质溶液为KOH溶液,负极上投放燃料甲烷,发生失电子发生氧化反应:CH4-8e-+10OH-═CO32-+7H2O,正极上投放氧气,发生得电子的还原反应:2O2+4H2O+8e-═8OH-,
故答案为:CH4-8e-+10OH-═CO32-+7H2O.
点评 本题考查了官能团的名称、有机物的命名、燃料电池电极反应式的书写,注意有机物命名时主链的选择,试题培养了学生的灵活应用能力,难度不大.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:解答题
| 实验 序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.63g,第二次称量读数为4.66g |
| 阴离子符号 | 物质的量浓度(mol/L) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4、BaC12、K2CO3、KNO3 | B. | HC1、NaNO3、Na2CO3、(NH4)2SO4 | ||
| C. | NaOH、KC1、K2CO3、MgCl2 | D. | NaAlO2、NaC1、Na2CO3、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
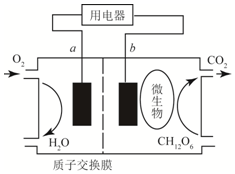
| A. | 该电池能够将电能转化为化学能 | |
| B. | b为该电池的正极 | |
| C. | 放电过程中,H+从a极区向b极区迁移 | |
| D. | 在电池反应中,正极上每消耗5.6L(标准状况下)气体时,则有NA个H通过质子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学小组设计了铜与浓、稀硝酸反应的一体化实验装置如图所示(部分固定装置省略),实验步骤如下.请回答下列问题:
某化学小组设计了铜与浓、稀硝酸反应的一体化实验装置如图所示(部分固定装置省略),实验步骤如下.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com