
【题目】下列离子方程式正确的是
A. 氯碱工业中电解饱和食盐水:2Cl﹣+2H2O![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
B. 氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+
C. 氢氧化钠溶液吸收少量二氧化硫SO2+OH﹣=HSO3﹣
D. 稀硫酸中加氢氧化钡溶液至中性:Ba2++H++OH﹣+SO42﹣=BaSO4↓+H2O
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】有可逆反应A+B![]() 2C在不同温度下经过一定时间,混合物中C的百分含量与温度关系如下图所示,那么:
2C在不同温度下经过一定时间,混合物中C的百分含量与温度关系如下图所示,那么:
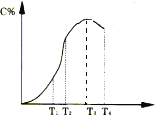
(1)反应在___________________温度下达到化学平衡;
(2)此反应在正反应为______________________热反应;
(3)由T1向T2变化时,V正____________V逆(填>、<、=);
(4)由T3向T4变化时,V正_____________V逆(填>、<、=)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2molSO2和lmolO2,发生下列反应: 2SO2(g)+ O2(g)![]() 2SO3(g),达到平衡后改变下述条件,再次平衡后SO3气体浓度不变的是
2SO3(g),达到平衡后改变下述条件,再次平衡后SO3气体浓度不变的是
A. 保持温度和容器体积不变,充入1molSO3(g)
B. 保持温度和容器内压强不变,充入1molSO3(g)
C. 保持温度和容器内压强不变,充入1molO2(g)
D. 保持温度和容器内压强不变,充入1molAr(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同分异构体的是( )
A.O2和O3B.CH3CH3和CH2=CH2
C.金刚石和石墨D.CH3CH2CH2CH3和CH3(CH3)CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,向1 L 0.5 mol/L的NaOH溶液中加入稀醋酸、浓H2SO4、稀HNO3,则恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是
A.ΔH1>ΔH2>ΔH3B.ΔH1<ΔH3<ΔH2
C.ΔH2>ΔH1>ΔH3D.ΔH1>ΔH3>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答: 
(1)实验中观察到的现象是 .
A.试管中镁片逐渐溶解
B.试管中产生无色气泡
C.烧杯外壁变冷
D.烧杯底部析出少量白色固体
(2)试管中发生的反应属于(选填“氧化还原反应”或“非氧化还原反应”).
(3)写出有关反应的离子方程式 .
(4)由实验推知,MgCl2溶液和H2的总能量(填“大于”“小于”“等于”)镁片和盐酸的总能量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
序号 | 纯锌粉(g) | 2.0 mol·L-1 硫酸溶液(mL) | 温度 (℃) | 硫酸铜固体(g) | 加入蒸馏水(mL) |
Ⅰ | 2.0 | 50.0 | 25 | 0 | 0 |
Ⅱ | 2.0 | 40.0 | 25 | 0 | 10.0 |
Ⅲ | 2.0 | 50.0 | 25 | 0.2 | 0 |
Ⅳ | 2.0 | 50.0 | 25 | 4.0 | 0 |
①本实验待测数据可以是________________________,实验Ⅰ和实验Ⅱ可以探究________________对锌与稀硫酸反应速率的影响。
②实验Ⅲ和实验Ⅳ的目的是________________,写出有关反应的离子方程式
_______________________________________________________________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:

表中Vx=________mL,理由是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。实验室由铬铁矿粉制备重酪酸流程如图所示:

已知步骤①的主要反应为:
![]()
(未配平)。有关物质的溶解度如图所示。

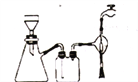
回答下列问题:
(1)滤渣2的主要成分是_________及含硅杂质。
(2)步骤④调滤液2的pH最合适的试剂是______________。
A.H2SO4溶液 B.KOH溶液 C.浓盐酸 D.K2CO3粉末
如何最简单的方法粗略判断pH已调至合适范围_________________。
(3)向“滤液3”中加入适量KCl,蒸发浓缩至_____________________,停止加热,然后冷却结晶,得到的K2Cr2O7固体产品。
(4)本实验过程中多次用到抽滤的装置,下列关于抽滤的说法正确的是_______。
A.抽滤时,先用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
B.右图抽滤装置中只有2处错误
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀,减小沉淀的损失。
(5)某同学用mg铬铁矿粉(含Cr2O3 40%)制备K2C r2O7,为了测定产率,该同学设计了以下实验:将所有产品加水溶解并定容于500mL容量瓶中,移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加入过量2mol·L-1H2SO4,再加1.1KI,加塞摇匀,充分反应后铬完全以Cr3+存在,于暗处静置5min后,加指示剂,用0.0250mol·L-1标准Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液20.00mL。(已知:2 Na2S2O3+I2=Na2S4O6+2NaI)若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使产量的测量结果__________(填“偏高”“偏低”或“无影响”)。计算该同学的产量_____________x100%(用含是m的式子表示,要求化简,m的系数保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com