
分析 无色溶液中不存在Cu2+、MnO4-,
①取少量该溶液,加过量盐酸,有气体生成,得到甲溶液,说明含有CO32-,则一定不存在Ag+、Ba2+、Al3+,由电荷守恒可知一定存在Na+;
②取少量甲溶液,向其中加硝酸酸化的硝酸银溶液,出现白色沉淀,说明生成AgCl,但由于加入盐酸,则不能说明是否含有Cl-,以此解答该题.
解答 解:(1)无色溶液中不存在Cu2+、MnO4-,取少量该溶液,加过量盐酸,有气体生成,得到甲溶液,说明含有CO32-,则一定不存在Ag+、Ba2+、Al3+,
故答案为:Cu2+、MnO4-、Ag+、Ba2+、Al3+;
(2)阳离子只有Na+,一定存在,生成气体,说明存在CO32-,故答案为:Na+、CO32-;
(3)取少量甲溶液,向其中加硝酸酸化的硝酸银溶液,出现白色沉淀,说明生成AgCl,但由于加入盐酸,则不能说明是否含有Cl-,故答案为:Cl-.
点评 本题考查离子检验,为高频考点,侧重考查学生的分析能力和实验能力,本题难度不大,做题时注意反应的现象,排除离子的相互干扰.


科目:高中化学 来源: 题型:填空题
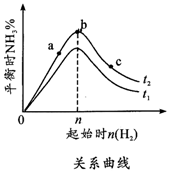 (1)在其他条件不变的情况下,起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)△H<0反应的影响可表示成如图所示的规律(图中t表示温度,n表示物质的量).
(1)在其他条件不变的情况下,起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)△H<0反应的影响可表示成如图所示的规律(图中t表示温度,n表示物质的量).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
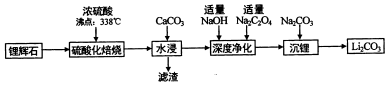
| 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeC13 | B. | Na2CO3 | C. | KNO3 | D. | FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com