
下列实验能够成功的是( )
|
| A. | 只用溴水一种试剂可鉴别甲苯、己烯、乙醇、四氯化碳四种液体 |
|
| B. | 用苯和溴水在Fe催化下可制的溴苯 |
|
| C. | 用乙醇、冰醋酸和pH=1的H2SO4溶液混合加热可制备乙酸乙酯 |
|
| D. | 用酚酞可鉴别苯酚钠和乙酸钠两种溶液 |
| 有机物的鉴别;有机化学反应的综合应用. | |
| 专题: | 有机反应. |
| 分析: | A.甲苯、四氯化碳不溶于水、二者密度大小不同,己烯含有碳碳双键,可发生加成反应,乙醇易溶于水,以此进行判断; B.应用苯和液溴; C.应用浓硫酸; D.苯酚钠和乙酸钠两种溶液都呈碱性,浓度不确定,不能鉴别. |
| 解答: | 解:A.加入溴水,甲苯不溶于水,密度比水小,色层在上层,己烯与溴发生加成反应,溴水褪色,乙醇和水混溶,无现象,四氯化碳不溶于水,密度比水大,色层在下层,可鉴别,故A正确; B.应用苯和液溴在催化剂条件下反应制备溴苯,故B错误; C.乙醇和乙酸的酯化反应应用浓硫酸作催化剂,故C错误; D.苯酚钠和乙酸钠两种溶液都呈碱性,浓度不确定,不能鉴别,可加盐酸后再加入氯化铁溶液鉴别,故D错误. 故选A. |
| 点评: | 本题考查有机物的鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握有机物的结构和性质的异同,难度不大. |


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,能达到实验目的的是( )

A.用图甲装置进行稀硝酸与铜的反应制取并收集NO
B.用图乙装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
C.用图丙装置检验电流的方向
D.用图丁装置制取少量Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
下表各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
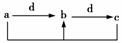
| 物质 选项 | a | b | c | d |
| A | Al | Al(OH)3 | NaAlO2 | NaOH |
| B | CH3CH2OH | CH3CHO | CH3COOH | O2 |
| C | Na2CO3 | NaHCO3 | NaOH | CO2 |
| D | Cl2 | FeCl3 | FeCl2 | Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和________。
(2)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为________。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率( ×100%)随温度的变化如下图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
×100%)随温度的变化如下图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
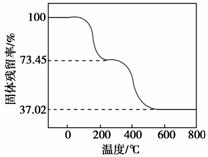
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO )(写出计算过程)。
)(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应离子方程式正确的是( )
|
| A. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO3﹣+2OH﹣═CaCO3↓+CO32﹣+2H2O |
|
| B. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O |
|
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═AlO42﹣+4NH4++2H2O |
|
| D. | H2SO4与Ba(OH)2溶液反应:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁溶于一定浓度的硝酸溶液时,发生反应的离子方程式为:aFe+bNO3﹣+cH+=dFe2++fFe3++gNO↑+hNO2↑+kH2O下列有关推断中,不正确的是( )
|
| A. | 2d+3f=3g+h |
|
| B. | 反应中每消耗5.6 g Fe,转移0.2mol~0.3mol e﹣ |
|
| C. | HNO3的氧化性大于Fe3+ |
|
| D. | 当a不变时,d随着b的增大而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO2﹣、MnO4﹣、CO32﹣、SO42﹣中的若干种离子组成,取溶液进行如图实验:
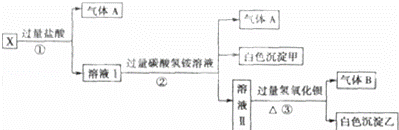
(1)白色沉淀甲是 .
(2)X溶液中一定存在的离子是 .
(3)白色沉淀乙中一定有: ,可能有 .
(4)若将过量的气体A与适量的气体B通入水中,写出反应的化学方程式 3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
I.将一定量NO2和N2O4的混合气体通入体积为1L 的恒温密闭容器中,各物
的恒温密闭容器中,各物
质浓度随时间变化的关系如图1所示。

请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为
;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
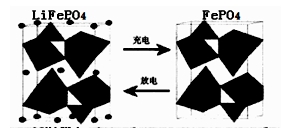
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-, 且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com