
| A. | 氯化镁的分子式为MgCl2 | B. | 氮原子的轨道表达式为: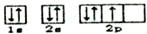 | ||
| C. | 硫原子的外围电子排布式为3s23p4 | D. | N2的结构式: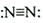 |
分析 A:氯化镁为离子晶体;
B、氮原子的电子排布式为1S22S22P3;
C、原子或离子核外电子排布属于基态排布应满足构造原理;
D、先写出氮气的电子式,将共用电子对用“-”表示即为结构式;
解答 解:A:氯化镁为离子晶体,不存在分子,应是氯化镁的化学式为MgCl2,故A错误;
B、氮原子的电子排布式为1S22S22P3,故轨道表达式为: ,故B正确;
,故B正确;
C、原子或离子核外电子排布属于基态排布应满足构造原理,S外围电子排布式应为3s23p4,故C正确;
D、氮气为共价单质,氮原子最外层有5个电子,其电子式为: ,则结构式为
,则结构式为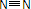 ,故D错误;
,故D错误;
故选BC.
点评 本题考查化学用语的使用,学生明确原子的最外层电子数及物质的类别、电子式的书写方法是解答本题的关键.


科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
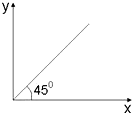
| A. | 第二周期的核电荷数和最高化合价之间的关系 | |
| B. | 烷烃中碳原子数(X)与氢原子数(Y)的关系 | |
| C. | 温度大于100℃时,CH4和C2H4的混合气体在氧气中充分燃烧,同温同压下燃烧前后参与反应的气体的体积之和(X)与生成物的气体体积之和(Y)的关系 | |
| D. | 燃烧一定质量C2H4与C3H6的混合气体,消耗O2的物质的量(Y)与C3H6的质量分数(X)的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
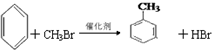 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种.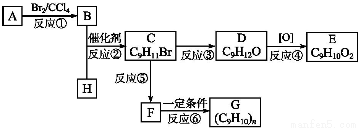
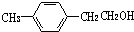 ,F的分子式C9H10.
,F的分子式C9H10.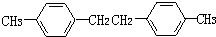 .
.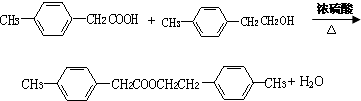 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com