
 >H2CO3>
>H2CO3> >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将 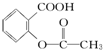 转变为
转变为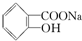 的最佳方法是( )
的最佳方法是( )| A. | 与足量的NaOH溶液共热后,再通入足量CO2 | |
| B. | 与足量的NaOH溶液共热后,再加入适量H2SO4 | |
| C. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| D. | 与稀H2SO4共热后,加入足量的Na2CO3溶液 |
科目:高中化学 来源: 题型:选择题
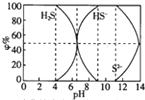 25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布如图如下,下列结论正确的是( )
25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布如图如下,下列结论正确的是( )| A. | 当c(HS-)>c(S2-)时,溶液一定显酸性 | |
| B. | 当pH=7时,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 当4<pH时,向其中滴加0.1mol/LCuSO4都有CuS沉淀(Ksp(CuS)=6.3×10-36) | |
| D. | 当pH=9时,溶液中有c(H+)=c(OH-)+c(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+.Al3+.Cl-.NO3- | B. | K+.Fe3+.Cl-.SiO32- | ||
| C. | H+.Fe2+.SO42-.Br2 | D. | K+.Ag+.NH3•H2O.NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两性氧化物 | B. | 两性氢氧化物 | C. | 盐 | D. | 有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有第2列元素的原子最外层有2个电子 | |
| B. | 第3列元素种类最多 | |
| C. | 第15列元素的最高价氧化物为R2O5 | |
| D. | 第17列元素的第一种元素无含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=1,n=5 | B. | m=3,n=4 | C. | m=5,n=1 | D. | m=3,n=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成分子晶体的微粒中一定含有共价键 | |
| B. | 在结构相似的情况下,原子晶体中的共价键越强,晶体的熔沸点越高 | |
| C. | 某分子晶体的熔、沸点越高,分子晶体中共价键的键能越大 | |
| D. | 分子晶体中只存在分子间作用力而不存在任何化学键,所以其熔、沸点一般较低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com