
已知稀有元素氡(86Rn)和锕系元素钍(90Th)均是放射性元素,其中某种同位素进行如下放射性衰变![]() .在上述两式中,分别用X和Y代表它们衰变后生成的新元素.试回答下列问题:
.在上述两式中,分别用X和Y代表它们衰变后生成的新元素.试回答下列问题:
(1)X在元素周期表的位置________,判断依据是________.
(2)Y元素最高价氧化物化学式为________,其对应水化物显________性(填“强酸”“强碱”“弱酸”“弱碱”或“中”).
(3)在上述变化中产生的α射线是一粒子流,每个粒子带两个单位正电荷,若它结合2个电子,应变为________(填元素符号).
|
答案:(1)第6周期ⅥA族 原子序数比84小且最相近的稀有气体54Xe位于第5周期,又X在周期表中的纵行数为84-54-15=16,为ⅥA族 (2)YO强碱 (3)He 解析:X和Y的原子序数分别为84和88,可用其原子序数减去比它小而最相近的稀有气体元素的原子序数,即得X和Y在周期表中的纵行数,再确定其对应的族序数;其周期数比最相近的稀有气体元素的周期数大1.则原子序数比X小且最相近的稀有气体为54Xe,故X位于第6周期.X在周期表中的纵行数为84-54-14=16,故X位于ⅥA族. 同样办法推出Y位于第7周期ⅡA族,为金属活泼性强于Ba的Ra,则Ra(OH)2肯定为强碱. |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:阅读理解
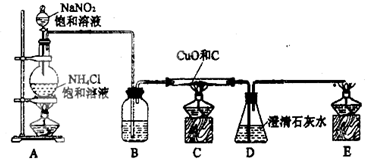
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
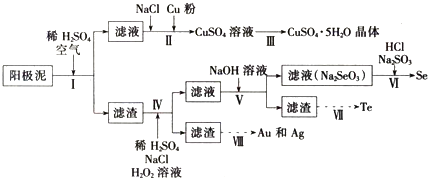
| 主要成分 | Cu | Ag | Au | Se | Te |
| 百分含量/% | 23.4 | 12.1 | 0.9 | 6.7 | 3.1 |
| 固定浸出温度 | 固定H2SO4浓度 | |||||||||||
| H2SO4浓度/mol?L-1 | 浸出率/% | 浸出温度/℃ | 浸出率/% | |||||||||
| Cu | Ag | Au | Se | Te | Cu | Ag | Au | Se | Te | |||
| 4 | 95.1 | 4.67 | <0.2 | 0.83 | 8.93 | 30 | 87.1 | 4.58 | <0.2 | 0.08 | 6.83 | |
| 3 | 94.5 | 4.65 | <0.2 | 0.28 | 6.90 | 40 | 94.5 | 4.65 | <0.2 | 0.28 | 6.90 | |
| 2 | 78.1 | 2.65 | <0.2 | 0.05 | 2.85 | 50 | 96.1 | 5.90 | <0.2 | 0.64 | 8.73 | |
查看答案和解析>>
科目:高中化学 来源:2010年山东省潍坊市高三上学期开学摸底考试化学试题 题型:填空题
(选做题)(19分)图表法、模型法是常用的科学研究方法。
I.下图是研究部分元素的氢化物的沸点变化规律的图像。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b(其中A点对应的沸点是100℃),你认为正确的是 ,理由是 。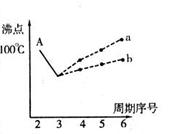
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,价电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 。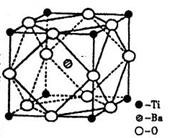
III.上世纪60年化,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对情性”的观念。在随后的几年内,科学家又相继后成了氙的氟化物、氧化物等。
(1)金属Pt内部原子的堆积方式与铜及干冰中的CO2相同,右图正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置 。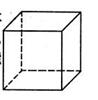
(2)稀有气体(氡除外)中,只有较重的氙能合成出多种化合物,
其可能原因是 (填字母代号)
| A.氙的含量比较丰富 | B.氙的相对原子质量大 |
| C.氙原子半径大,电离能小 | D.氙原子半径小,电负性大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com