
 .
. .
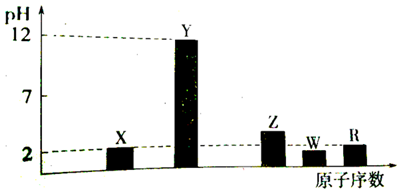
.分析 I.由部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol/L-1)溶液的pH和原子序数关系可知,NaOH溶液的pH为12,Y为Na,硝酸的pH=2,X为N元素,Z对应pH>2,为磷酸,则Z为P,W对应pH<2,为硫酸,所以W为S;R对应pH=2,且原子序数最大,所以R是Cl.
II.(1)A.非金属性越强,越易与氢气化合;
B.最高价含氧酸的酸性可说明碳与硫两元素非金属性相对强弱;
C.非金属性强的显负价;
(2)COS分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,则C与O、C与S均形成两对共有电子对;
(3)①Ge在Si的下方,第四周期有18种元素;
②同主族从上到下金属性增强,金属性越强,对应最高价氧化物对应水化物的碱性越强;
Ⅲ.金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根离子的质量为2.54g-1.52g=1.02g,氢氧根离子的物质的量为$\frac{1.02g}{17g/mol}$=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根离子的物质的量,结合电子守恒及质量计算.
解答 解:I.由部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol/L-1)溶液的pH和原子序数关系可知,NaOH溶液的pH为12,Y为Na,硝酸的pH=2,X为N元素,Z对应pH>2,为磷酸,则Z为P,W对应pH<2,为硫酸,所以W为S;R对应pH=2,且原子序数最大,所以R是Cl.
(1)元素R在周期表中的位置是第三周期第ⅦA族,元素Z的原子结构示意图是 ,故答案为:第三周期第ⅦA族;
,故答案为:第三周期第ⅦA族; ;
;
(2)元素Y和W形成的Y2W2型化合物是Na2S2中含有化学键的类型为离子键、非极性共价键,故答案为:离子键、非极性共价键;
II.(1)A.S与H2发生化合反应比C与H2化合更容易,则能说明碳与硫两元素非金属性相对强弱关系为:S>C,故A正确;
B.酸性:H2SO3>H2CO3,亚硫酸不是最高价含氧酸,不能说明碳与硫两元素非金属性相对强弱,故B错误;
C.CS2中碳元素为+4价,硫元素为-2价,能说明碳与硫两元素非金属性相对强弱关系为:S>C,故C正确;
故答案为:AC;
(2)COS分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,则C与O、C与S均形成两对共有电子对,用电子式表示羰基硫分子的形成过程为 ,故答案为:
,故答案为: ;
;
(3)①Ge在Si的下方,第四周期有18种元素,Ge的原子序数为14+18=32,故答案为:32;
②同主族从上到下金属性增强,金属性越强,对应最高价氧化物对应水化物的碱性越强,则最高价氧化物对应水化物的碱性由强到弱顺序为Pb(OH)4>Sn(OH)4>Ge(OH)4,
故答案为:Pb(OH)4>Sn(OH)4>Ge(OH)4;
Ⅲ.金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根离子的质量为2.54g-1.52g=1.02g,氢氧根离子的物质的量为$\frac{1.02g}{17g/mol}$=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根离子的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则$\left\{\begin{array}{l}{2x+2y=0.06}\\{64x+24y=1.52}\end{array}\right.$,解得:x=0.02mol、y=0.01mol,铜镁合金中铜与镁的物质的量之比是2:1,
故答案为:2:1.
点评 本题考查原子结构与元素周期律,为高频考点,把握酸碱溶液的pH、原子序数来推断元素为解答本题关键,侧重分析与应用能力的考查,注意规律性知识的应用,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:实验题
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$
 ;
;


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用如图所示装置检验生成气体时,不能达到目的是( )
用如图所示装置检验生成气体时,不能达到目的是( )| 选项 | 生成的气体 | 试剂X | 试剂Y |
| A | 电石与水反应制取的乙炔 | CuSO4溶液 | 溴水 |
| B | 木炭与浓H2SO4加热得到的二氧化碳 | 饱和NaHCO3溶液 | 澄清石灰水 |
| C | CH3CH2Br与NaOH醇溶液共热得 到的乙烯 | 水 | KMnO4 酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | 溴水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若平衡时两容器中的压强不相等,则两容器中压强之比为8:5 | |
| B. | 若平衡时,甲、乙两容器中A的物质的量相等,则x=2 | |
| C. | 若平衡时,甲、乙两容器中A的物质的量不相等,则x=3 | |
| D. | 若平衡时,甲、乙两容器中A的物质的量相等,改为按不同配比作为乙的起始物质,达到平衡后,C的体积分数都仍为0.2.反应从逆反应方向开始,则D的起始物质的量应满足的条件是n(D)>$\frac{4}{3}$ mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com