
 铬是用途广泛的金属元素.
铬是用途广泛的金属元素.分析 (1)①根据氧元素的化合价来确定Cr的化合价;
②根据氢离子对2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O平衡移动的影响判断;
③由c(Fe3+)和Ksp[Fe(OH)3]计算c(OH-),结合Ksp[Cr(OH)3]计算c(Cr3+);
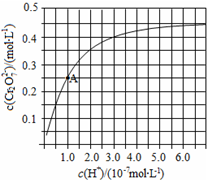
(2)①图象分析可知随氢离子浓度增大,铬酸根离子转化为重铬酸根离子;A点c(Cr2O72-)=0.25mol/L,c(H+)=10-7mol/L,c(CrO42-)=0.5mol/L,依据平衡常数概念计算,K=$\frac{c(C{r}_{2}{{O}_{7}}^{2}{\;}^{-})}{c{\;}^{2}(H{\;}^{+})c{\;}^{2}(Cr{{O}_{4}}^{2}{\;}^{-})}$;
②溶液酸性增大,平衡2CrO42-+2H+?Cr2O72-+H2O正向进行,CrO42-的平衡转化率增大;A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,H+浓度为1×10-7mol/L,计算反应的平衡常数;
③升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动,升高温度平衡向吸热方向移动,据此判断.
解答 解:(1)①Cr2O72-中O的化合价为-2价,由离子中元素化合价的代数和等于所带电荷数可得,Cr的化合价为+6,故答案为:+6;
②若平衡体系的pH=2,溶液酸性较强,平衡2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O正向移动,溶液呈橙色;
故答案为:橙;
③向Ⅱ反应后的溶液加一定量NaOH,若溶液中c(Fe3+)=2.0×10-12mol•L-1,则c(OH-)=$\root{3}{\frac{4.0×1{0}^{-38}}{2.0×1{0}^{-12}}}$mol/L,则c(Cr3+)=$\frac{6.0×1{0}^{-31}}{2.0×1{0}^{-26}}$=3×10-5,
故答案为:3.0×10-5;
(2)①随着H+浓度的增大,CrO42-转化为Cr2O72-的离子反应式为:2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
②溶液酸性增大,平衡2CrO42-+2H+?Cr2O72-+H2O正向进行,CrO42-的平衡转化率增大;A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,H+浓度为1×10-7mol/L,此时该转化反应的平衡常数为 K=K=$\frac{c(C{r}_{2}{{O}_{7}}^{2}{\;}^{-})}{c{\;}^{2}(H{\;}^{+})c{\;}^{2}(Cr{{O}_{4}}^{2}{\;}^{-})}$=$\frac{0.25}{0.{5}^{2}×(1{0}^{-7}){\;}^{2}}$=1.0×1014,
故答案为:1.0×1014;增大;
③升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动,说明正方向放热,则该反应的△H<0,
故答案为:小于.
点评 本题综合考查化学反应原理的分析与探究,为高频考点,侧重考查学生的分析、计算能力,题目涉及化学平衡常数、溶度积常数的计算的知识,注意平衡常数的理解应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3可用于治疗胃酸过多 | B. | 水玻璃浸泡过的木材能防腐 | ||
| C. | 明矾用于饮用水消毒 | D. | 晶体硅用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “面粉增白剂”中的过氧化钙(CaO2)属于氧化物 | |
| B. | “苏打水”中的碳酸氢钠,制作“毒豆芽”所用的亚硝酸钠都属于钠盐 | |
| C. | 35Cl和37Cl互称为同位素,红磷、白磷互为同素异形体 | |
| D. | “碘片”和“加碘盐”都属于混合物,其中“碘”是单质碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用电解法冶炼钠、镁、铝等活泼金属 | |
| B. | 粗铜精炼时,与电源负极相连的是纯铜,该电极反应式为Cu2++2e-=Cu | |
| C. | 由C(s,石墨)=C(s,金刚石)△H=+1.9kJ/mol可知,金刚石比石墨稳定 | |
| D. | 反应SO2(g)+2H2S(g)=3S (s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| C. | 中和等体积等物质的量浓度的盐酸和醋酸,所消耗的氢氧化钠的物质的量相同 | |
| D. | c(H+)相等的NH4Cl溶液和NaHSO4溶液,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将1 g铝片投入20 mL 18.4 mol•L-1的硫酸中 | |
| B. | 用50 mL浓盐酸与足量MnO2共热 | |
| C. | 向100 mL 3 moI•L-1的硝酸中加入5.6 g铁 | |
| D. | 在5×107 Pa、500℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 浓硝酸和稀硝酸都具有强氧化性 | 浓硝酸和稀硝酸均可使紫色石蕊试液先变红后褪色 |
| B | 浓硫酸具有强氧化性和吸水性 | 浓硫酸可干燥H2和CO,不可干燥 SO2和NH3 |
| C | SO2是酸性氧化物 | SO2可使含有酚酞的NaOH溶液褪色 |
| D | 铵盐受热易分解 | NH4Cl和NH4HCO3均可用作氮肥和制取氨气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀盐酸,沉淀不消失,则原溶液中一定有SO42- | |
| B. | 加入烧碱溶液后加热,产生能使湿润红色石蕊试纸变蓝的气体,则原溶液中一定有NH4+ | |
| C. | 加入盐酸,放出能使澄淸石灰水变浑浊的无色气体,则原溶液中一定有CO32- | |
| D. | 加入AgNO3溶液,有白色沉淀生成,则原溶液中一定含有NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com