
| A. | 金属Al无剩余 | B. | 有白色沉淀生成 | ||
| C. | 所得气体全部为氢气 | D. | Na的物质的量是0.6mol |
分析 等物质的量的Na和Al两种金属加入足量的水中,发生的化学反应有
2Na+2H2O=2NaOH+H2 ↑①,
2NaOH+2Al+2H2O=2NaAlO2+3H2↑②,
将方程式①+②得2Na+4H2O+2Al=2NaAlO2+4H2 ↑,以此来解答.
解答 解:A.由2Na+4H2O+2Al=2NaAlO2+4H2 ↑可知,当钠和铝的物质的量相等时,恰好反应生成偏铝酸钠和氢气,则Al无剩余,故A正确;
B.等物质的量时恰好生成偏铝酸钠,无白色沉淀,故B错误;
C.Na与水反应生成氢气,Al与碱溶液反应生成氢气,故C正确;
D.n(H2 )=$\frac{26.88L}{22.4L/mol}$=1.2mol,由2Na+4H2O+2Al=2NaAlO2+4H2 ↑可知,Na的物质的量是$\frac{1.2mol}{2}$=0.6mol,故D正确;
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意钠与Al的物质的量相同,题目难度不大.


科目:高中化学 来源: 题型:选择题
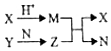 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )| A. | 相对分子质量M>N,沸点N>M | B. | 原子半径:D>B>C>A | ||
| C. | Z为Na2CO3 | D. | 图中有两个氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
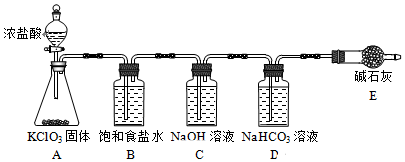
| 实验步骤 | 实验现象 | ||
| B瓶 | C瓶 | D瓶 | |
| 实验1:取样,滴加紫色石蕊溶液 | 变红,不褪色 | 变蓝,不褪色 | 立即褪色 |
| 实验2:取样,测定溶液的pH | 3 | 12 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 若元素Y处于第3周期,它可与冷水剧烈反应 | |
| C. | 元素X与氯形成化合物时,化学式可能是XCl | |
| D. | 元素Y是ⅢA族的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在温度、压强一定的条件下,仅熵因素决定一个化学反应的方向 | |
| B. | 温度、压强一定时,放热的熵增加反应一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 固体的溶解过程与熵变无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
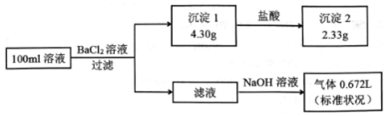
| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 是否存在Na+只有通过焰色反应才能确定 | |
| C. | 原溶液一定存在Na+,可能存在Cl- | |
| D. | 若原溶液中不存在Cl-,则c (Na+)=0.lmol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子组 | 加入试剂 | 加入试剂后发生反应 | |
| A | K+、Fe2+、I- | 少量的酸性KMnO4溶液 | 5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O |
| B | Fe3+、I-、SO42- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | Ba2+、HCO3-、Cl- | NaOH溶液 | HCO3-+OH-═CO32-+H2O |
| D | Al3+、Cl-、NO3- | 过量浓氨水 | Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com