
| A. | 因为稀硫酸能与铁反应放出H2,所以稀硝酸与铁反应也一定能放出H2 | |
| B. | 因为Mg可以与水反应放出H2,所以Ca也可以与水反应放出H2 | |
| C. | 因为CO2的水溶液可以导电,所以CO2是电解质 | |
| D. | 因为SO2可以使酸性KMnO4溶液褪色,所以SO2具有漂白性 |
分析 A、稀硫酸是非氧化性的酸,但是稀硝酸的氧化性较强;
B、金属Mg和金属Ca是同主族元素,性质具有相似性;
C、二氧化碳的水溶液导电是因为二氧化碳和水反应生成了碳酸;
D、二氧化硫能被强氧化剂氧化.
解答 解:A、稀硫酸是非氧化性的酸,能与铁反应放出H2,但是稀硝酸的氧化性较强,稀硝酸与铁反应放出的是一氧化氮,故A错误;
B、金属Mg和金属Ca是同主族元素,性质具有相似性,因此两者均可以与水反应放出H2,故B正确;
C、二氧化碳的水溶液导电是因为二氧化碳和水反应生成了碳酸,碳酸水溶液导电,不是二氧化碳本身导电,故C错误;
D、二氧化硫能被强氧化剂高锰酸钾氧化,体现了二氧化硫的还原性,故D错误.
故选B.
点评 本题考查的知识点较多,解题关键是抓住定义和物质的性质,对于错误的推理要通过反例推翻.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
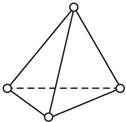 (1)根据要求填空:
(1)根据要求填空:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
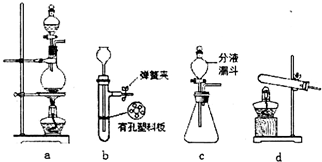 硫化亚铁是一种黑色块状固体,常温下难溶于水,易溶于酸而生成能溶于水的硫化氢气体.硫化亚铁在空气中煅烧时生成二氧化硫气体和烧渣.
硫化亚铁是一种黑色块状固体,常温下难溶于水,易溶于酸而生成能溶于水的硫化氢气体.硫化亚铁在空气中煅烧时生成二氧化硫气体和烧渣.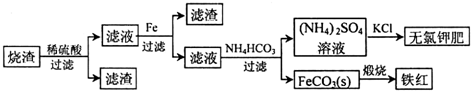

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4含有4nA个Cl原子 | |
| B. | 7.8 g Na2O2与足量水反应转移0.2nA个电子 | |
| C. | 0.1 mol•L-1NaCl溶液中含有0.1nA个Na+ | |
| D. | 常温常压下,23 gNO2、N2O4混合气体中含有nA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为除去FeSO4溶液中的Fe2(SO4)3,可加入铁粉,再过滤 | |
| B. | 除去乙醇中的水:加入生石灰,蒸馏 | |
| C. | 为除去乙炔气中少量的H2S,可使其通过CuSO4溶液 | |
| D. | 为除去CO2中少量的SO2,可使其通过饱和Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
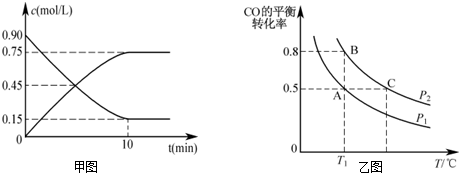
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com