
【题目】工业生产需要大量原料,消耗大量能源,在得到所需产品同时产生了大量废气、废水、废渣。某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:
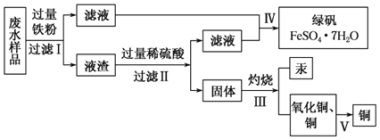
(1)步骤Ⅰ中加入过量铁粉的目的是_______________________________。
(2)步骤Ⅱ中________(填“能”或“不能”),用盐酸代替硫酸,写出步骤Ⅱ中涉及反应的化学方程式:____________________________________。
(3)步骤Ⅳ得到绿矾的操作蒸发浓缩______________、______________、洗涤、干燥。现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是___________。
(4)步骤 V利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。从安全角度考虑,方案_________不好;从产品纯度考虑,方案_________不好。
【答案】将Cu2+、Hg2+部置换出来 不能 Fe+H2SO4=FeSO4+H2↑ 冷却结晶 过滤 漏斗 甲、乙 丙
【解析】
(1)加入过量的铁粉,可以将Cu2+、Hg2+全部转化为单质置换出来;
(2)步骤Ⅱ中不能用盐酸代替硫酸,若用稀盐酸代替稀硫酸,制得的绿矾中会混有氯化亚铁,步骤Ⅱ中稀硫酸与铁反应生成硫酸亚铁和氢气,涉及反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑;
(3)步骤Ⅳ得到绿矾的操作蒸发浓缩、冷却结晶、过滤、洗涤、干燥。完成步骤Ⅳ的实验操作需要的仪器有:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台、漏斗等,故完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是漏斗;
(4)氢气、一氧化碳易燃,用其还原氧化铜存在不安全因素,用碳还原氧化铜,所得铜中易混有炭粉。故从安全角度考虑,方案甲、乙不好;从产品纯度考虑,方案丙不好。


科目:高中化学 来源: 题型:
【题目】用下图实验装置制取干燥的气体正确的是

A | B | C | D |
大理石与盐酸 | 锌粒与稀硫酸 | 双氧水与二氧化锰 | 二氧化锰与氯酸钾 |
浓硫酸 | 浓硫酸 | 无水氯化钙 | 浓硫酸 |
CO2 | H2 | O2 | O2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是
A.发展氢能和太阳能
B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学
D.尽量用纯液态有机物代替水作溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以惰性电极电解下列物质的水溶液(电解质均过量),电解后溶液pH升高的是( )
①盐酸 ②硫酸 ③氢氧化钾 ④氯化钾 ⑤硝酸银 ⑥硫酸钠
A. ①②③ B. ④⑤⑥ C. ①③④ D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:
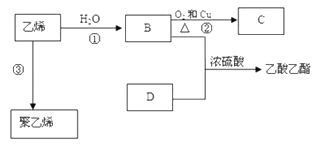
(1)乙烯的结构式为:___________________ .
(2)写出化合物官能团的化学式及名称:B中含官能团的化学式____________________;官能团名称_____________________;
(3)写出反应的化学方程式②___________,____________反应类型;③__________________________,反应类型__________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂(成分假设全部为硬脂酸甘油酯)经皂化反应后,反应所得的硬脂酸钠在水里形成的分散系属于( )
A. 溶液 B. 乳浊液
C. 悬浊液 D. 胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等电子原理:原子数相同、最外层电子总数相同的分子互称为等电子体。等电子体的结构、物理性质均相似。
(1)根据以上原理,仅由第二周期元素组成的共价化合物分子中,互为等电子体的是__________和__________;________和________。
(2)此后,等电子原理又有发展。例如:由短周期元素组成的粒子,只要其原子总数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO![]() 互为等电子体的分子有:_________(写出一种即可)。
互为等电子体的分子有:_________(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在______ molAl2(SO4)3中含0.3 mol SO42–,含Al3+约_______________个。
(2)同温同压下,相同质量的SO2气体和SO3气体,其分子数之比为_________,密度之比为_________。
(3)质量同为46 g的两种气体,NO2和N2O4,物质的量之比为________,二者所含O原子个数之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
磷及其化合物是生活生产中重要的组成部分,以下是一些常见的磷的化合物:
(1)与磷同主族、比磷多一个周期的元素基态原子的价层电子排布为___________.
(2)磷与同周期相邻的两种元素的第一电离能由大到小的顺序为__________。(用元素符号表示)。
(3)亚磷酸(H3PO3)是一种常见的无机酸,其与过量的NaOH溶液反应生成Na2HPO3,请画出亚磷酸的分子结构_______。亚磷酸可作还原剂将Cu2+还原为单质,得到的电子填充到________轨道。
(4)己知PBr5晶体中存在PBr4+,和Br-两种离子,则PBr4+,中心P原子杂化类型为___,该离子的几何构型为______。而PCl5晶体中存在PCl4+和另一种阴离子,该阴离子配位数为6,请写出该离子的化学式:______。PBr5晶体中不能形成与PCl5晶体一样的阴离子的原因可能是:_________。
(5)铝和白磷在一定条件下可以制备磷化铝(AlP),磷化铝晶胞的结构如图,可以将其看做Si晶体的“广义等电子体”,可做半导体材料.
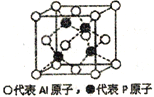
①根据“广义等电子原理”,下列物质中,可能是半导体的有____________.
A. SiC B.CaO2 C. GaAs D.Si3N4 E.BN
②磷化铝中,Al原子的配位数为_______,若该晶胞密度为dg/cm3,用NA表示阿伏伽德罗常数,则该晶体的边长为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com