
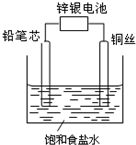
 锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:分析 (1)原电池内部阳离子向正极移动,锌在负极失电子生成氧化锌;
(2)氧化银受热分解生成Ag和氧气;
(3)Cu作阳极,Cu失电子生成铜离子,铅笔芯作阴极,阴极上氢离子得电子生成氢气和氢氧根离子,铜离子与氢氧根离子结合生成沉淀.
解答 解:(1)已知电池总反应为Zn+Ag2O═ZnO+2Ag,Zn失电子作负极,Ag作正极,原电池内部阳离子向正极移动;锌在负极失电子生成氧化锌,则负极的电极反应式为:Zn-2e-+2OH-=ZnO+H2O;
故答案为:正极;Zn-2e-+2OH-=ZnO+H2O;
(2)氧化银受热分解生成Ag和氧气,其化学方程式为2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑;
故答案为:2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑;
(3)Cu作阳极,Cu失电子生成铜离子,铅笔芯作阴极,阴极上氢离子得电子生成氢气和氢氧根离子,铜离子与氢氧根离子结合生成沉淀,电解方程式为Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑;
故答案为:负极;Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑.
点评 本题考查原电池与电解池工作原理、金属冶炼等,注意把握电极的判断方法和电极方程式的书写方法,题目难度中等,侧重于考查学生对基础知识的应用能力和分析能力.


科目:高中化学 来源: 题型:选择题
| A. | HNO3、NaOH、BaSO4均属于电解质 | |
| B. | SO2、NO2、CO2均能形成酸雨 | |
| C. | NH4HCO3、NH4Cl、I2受热后均无固体剩余 | |
| D. | FeCl2、NaHSO3、Fe(OH)3均能通过化合反应直接制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的最外层只有1个电子 | |
| B. | 元素X常见化合价为+3 | |
| C. | X原子核外有3个未成对电子 | |
| D. | 元素X最高价氧化物的水合物为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 粉末中一定有Na2O、Na202、NaHC03 | |
| B. | 粉末中一定不含有Na2C03和NaCl | |
| C. | 粉末中一定不含有Na20和NaCl | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对该反应速率的影响; c.实验①和④探究催化剂对该反应速率的影响. |
| ② | 298 | 0.5 | 0.0010 | |
| ③ | 323 | 0.5 | 0.010 | |
| ④ | 298 | 0 | 0.010 |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.0 | 7.0 | 7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
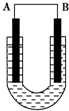 把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题:
把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和NaOH溶液 | B. | NH3和稀盐酸 | C. | NO2和水 | D. | SO2和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
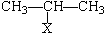 Ⅰ
Ⅰ CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.
CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点. 或
或
 CHBrCH3.
CHBrCH3. CHBrCH3与足量氢氧化钠溶液共热得到A,得到A时,苯环上没有化学键的断裂和生成.
CHBrCH3与足量氢氧化钠溶液共热得到A,得到A时,苯环上没有化学键的断裂和生成.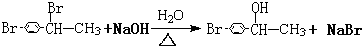 .
.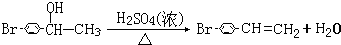 .
.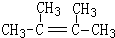 ,1molB完全燃烧时耗氧9mol
,1molB完全燃烧时耗氧9mol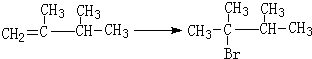
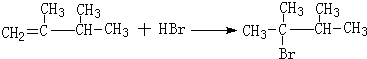
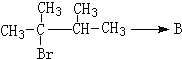
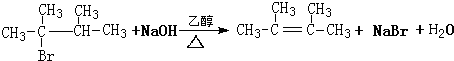 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com