
【题目】下列物质属于常见氧化剂的一组是
A.Cl2、O2、FeCl3、KMnO4
B.O2、KMnO4、H2、C
C.Na、K、FeCl2、H2、CO
D.CuO、CO、Fe2O3、H2
科目:高中化学 来源: 题型:
【题目】乙烯利(C2H6ClO3P)能释放出乙烯从而促进果实成熟,可由环氧乙烷![]() 和PCl3为原料合成。下列说法正确的是( )
和PCl3为原料合成。下列说法正确的是( )
A. 乙烯利、环氧乙烷均属于烃
B. PCl3分子中P原子最外层未满足8电子结构
C. 环氧乙烷与乙烷互为同系物
D. 工业上可以通过石油的裂解获得乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列判断正确的是
A.在18g18O2中含有NA个氧原子
B.22.4LCO2含有的共价键数目是4NA
C.1molCl2参加反应转移电子数一定为2NA
D.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关苯分子中的化学键描述正确的是( )
A. 每个碳原子的sp2杂化轨道中的其中一个形成大π键
B. 每个碳原子的未参加杂化的2p轨道形成大π键
C. 碳原子的三个sp2杂化轨道与其他形成两个σ键
D. 碳原子的未参加杂化的2p轨道与其他形成σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼铁高炉中存在以下热化学方程式:
Ⅰ.C(s) +CO2(g)==2CO(g) ΔH1=+172.5 kJ·mol-1
Ⅱ.Fe2O3(s) +CO(g)![]() 2FeO(s)+CO2(g) ΔH2=-3kJ·mol-1
2FeO(s)+CO2(g) ΔH2=-3kJ·mol-1
Ⅲ.FeO(s)+CO(g) ![]() Fe(s) +CO2(g) ΔH3=-11 kJ·mol-1
Fe(s) +CO2(g) ΔH3=-11 kJ·mol-1
Ⅳ. Fe2O3(s) +3CO(g) ![]() 2Fe (s)+3CO2(g) ΔH4
2Fe (s)+3CO2(g) ΔH4
(1)上述反应中,ΔH4=__________ kJ·mol-1。
(2)在实际生产中炼铁高炉中通人适量的空气,其主要作用是__________________。
(3)T℃时,在1L的密闭容器中加入20.0g Fe2O3和3.6gC,只发生反应:2 Fe2O3(s) +3C(s) ![]() 4Fe(s) +3CO2(g),20 min 后达到平衡,固体质量变为19.2 g,用CO2 表示的反应速率为________。
4Fe(s) +3CO2(g),20 min 后达到平衡,固体质量变为19.2 g,用CO2 表示的反应速率为________。
(4)炼铁过程中发生反应:2 Fe2O3(s) +3CO(g)![]() 2Fe(s) +3CO2(g)。
2Fe(s) +3CO2(g)。
①下图中能表示该反应的平衡常数对数值(1g K) 与温度的关系的是______(填“Ⅰ”或“Ⅱ”),原因是__________________。

②1500℃时,在某体积可变的密闭容器中按物质的量比2∶3加入Fe2O3 和CO,则达平衡时Fe2O3的转化率是________。
③下列说法能够提高Fe2O3 的转化率的是________(填字母)。
A.升高反应体系的温度 B.加人适量的Na2O 固体
C.对体系加压 D.增大CO 在原料中的物质的量比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验中手不慎被玻璃划破,可用FeCl3溶液应急止血,其主要原因可能是( )
A.FeCl3溶液有杀菌消毒作用
B.FeCl3溶液能使血液聚集沉降
C.FeCl3溶液能产生Fe(OH)3沉淀堵住伤口
D.FeCl3能使血液发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料。CO和H2的混合气体俗称合成气,可以在一定条件下制备CH3OH。
(1)若在密闭容器中充入CO和H2,研究其它条件不变时温度对合成甲醇反应影响:CO(g)+2H2(g) ![]() CH3OH(g),实验结果如图所示。
CH3OH(g),实验结果如图所示。
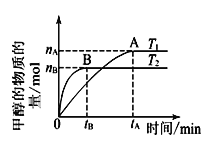
①温度高低比较:T1____T2。
②下列判断正确的是______________。
A.该反应是放热反应
B.该反应在T1时的平衡常数比T2时的小
C.由 T1到T2,ΔS减小
D.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
③在T1温度时,将1.00molCO和2.00molH2充入1.00L恒容密闭容器中,充分反应达到平衡后,若容器内气体的压强减小到开始时的一半,此时CO的转化率为______________,平衡常数为________________。(填计算结果)
(2)在一个恒容的密闭容器中发生反应CO(g)+2H2(g) ![]() CH3OH(g),在不同时间测定的各成分物质的量浓度如下表:
CH3OH(g),在不同时间测定的各成分物质的量浓度如下表:
时间 | 浓度(mol/L) | ||
c(CO) | c(H2) | c(CH3OH) | |
第0 min | 4.0 | 8.0 | 0 |
第10min | 3.8 | 7.6 | 0.2 |
第20min | 3.4 | 6.8 | 0.6 |
第30min | 3.4 | 6.8 | 0.6 |
第40min | 3.9 | 7.8 | 0.1 |
p>① CO的平均反应速率v(0min~10min)/ v(10min~20min)=________________。
② 若在第30min时改变了反应条件,改变的反应条件可能是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com