
根据如图所示装置回答:
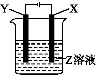
(1)当X为Pt,Y为Fe,Z为AgNO3时,阳极反应为 ,阴极反应为 ,电解反应为 。
(2)X为Cu,Y为Fe,Z为CuSO4时,阳极反应为 ,阴极反应为 。
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)2.2影响化学反应速率的因素(解析版) 题型:填空题
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol·L-1 H2SO4溶液/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第三章检测试卷(解析版) 题型:选择题
温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A.③①④②⑤
B.①③⑤④②
C.③②①⑤④
D.⑤②④①③
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.3电解原理的应用试卷(解析版) 题型:选择题
在铁制品上镀一定厚度的锌层,以下方案设计正确的是( )
A.锌作阳极,镀件作阴极,溶液中含有锌离子
B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.锌作阴极,镀件作阳极,溶液中含有锌离子
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.3.1电解原理试卷(解析版) 题型:选择题
右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液,下列实验现象中正确的是( )
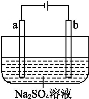
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.2一次电池二次电池试卷(解析版) 题型:选择题
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(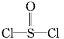 )中而形成的,电池总反应方程式为:8Li+3SOCl2
)中而形成的,电池总反应方程式为:8Li+3SOCl2 6LiCl+Li2SO3+2S,下列叙述中正确的是( )
6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.2.2燃料电池试卷(解析版) 题型:选择题
氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,已用于宇宙飞船及潜艇中,其电极反应为:
负极:2H2+4OH--4e- 4H2O 正极:O2+2H2O+4e-
4H2O 正极:O2+2H2O+4e- 4OH-
4OH-
所产生的水还可作为饮用水,今欲得常温下1 L水,则电池内电子转移的物质的量约为( )
A.8.9×10-3 mol
B.4.5×10-2 mol
C.1.1×102 mol
D.5.6×10 mol
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.2水的电离溶液的酸碱性(解析版) 题型:选择题
常温下,在0.01 mol·L-1硫酸溶液中,由水电离出的氢离子浓度是( )
A.5×10-13 mol·L-1B.0.02 mol·L-1 C.1×10-7 mol·L-1D.1×10-12 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com