
| 物质 | HF | H3PO4 |
| 电离平衡常数 | K=3.6×10-4 | 7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-=H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:F->HPO42->PO43- |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于Ksp(BaSO4)=1.1×10-10小于Ksp(BaCO3)=5.1×10-9,则不能使BaSO4沉淀转化为BaCO3沉淀 |
| B、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的最高温度作为末温度 |
| C、除去CH3COOC2H5中的CH3COOH先加足量的饱和Na2CO3溶液再蒸馏 |
| D、能使湿润的KI淀粉试纸变蓝的气体一定是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50% | B、33.3% |
| C、25% | D、20% |
查看答案和解析>>
科目:高中化学 来源: 题型:
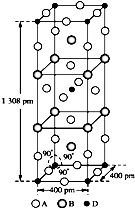 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 5 | 10 | 20 | 30 |
| n(A)/moL | 1 | 0.8 | 0.75 | 0.70 | 0.70 |
| A、反应在前 5s 的平均速率v (A)=0.04mol?L-1 |
| B、相同温度下,若平衡后再向容器中充入 0.5 mol A 和 0.5 mol C,反应再次达到平衡前v (正)>v (逆) |
| C、相同温度下,若平衡后移走 0.5 mol A 和 0.5 mol B,反应再次达到平衡时 c(C)小于 0.075 mol?L-1 |
| D、相同温度下,若起始时向容器中充入 2.0 mol C,达到平衡时,C 的转化率大于 70% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com