
| A. | 等质量的硫蒸汽和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | 由C(金刚石)═C(石墨)△H=-1.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | NH3的稳定性强,是因为其分子之间存在氢键 |
分析 A、硫蒸汽所含能量比硫固体高;
B、原电池中负极更易腐蚀;
C、能量越低越稳定;
D、非金属性越强,氢化物越稳定.
解答 解:A、硫蒸汽所含能量比硫固体高,所以等物质的量的硫蒸汽和硫固体分别完全燃烧,前者放出热量多,故A错误;
B、镀铜铁制品镀层受损后,构成铁铜原电池,铁制品比受损前更容易生锈,故B正确;
C、由C(金刚石)=C(石墨);△H=-1.90 kJ•mol-1可知石墨能量低,物质所含能量越低越稳定,所以石墨比金刚石稳定,故C错误;
D、NH3的稳定性强,是因为其N元素的非金属性强,N-H键稳定,其氢化物稳定,故D错误.
故选B.
点评 本题考查了反应热和焓变、物质稳定性的判断、中和热等知识,注意知识的归纳和梳理是关键,难度不大,注意把握中和热的含义.


科目:高中化学 来源: 题型:选择题
| A. | 溶液中存在CO32- | B. | 溶液中c(Na+)>c(CO32-) | ||
| C. | 与等物质的量的NaOH恰好中和 | D. | 溶液中c(H+)•c(OH-)=10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用漂白液时不可与酸性洁厕剂混用 | |
| B. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 | |
| C. | 葡萄糖、油脂、蛋白质等进入人体内经水解后被吸收 | |
| D. | 铝壶表面有致密氧化膜耐腐蚀,可长期存放食醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1溴丙烷与NaOH的醇溶液共热 | B. | 乙醛与H2加成 | ||
| C. | 乙醇与浓H2SO4共热到140℃ | D. | 1-溴丙烷与NaOH的水溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为285.8 kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1.若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 相对分子质量相同,结构不同的有机物互为同分异构体 | |
| B. | 同分异构体间的相互转化一定伴随着能量的变化 | |
| C. | C4H10的一氯取代物共有4种结构 | |
| D. | 甲苯(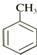 )苯环上的氢原子被一个氯原子取代,共有3种同分异构体 )苯环上的氢原子被一个氯原子取代,共有3种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的漂白性 | B. | S的还原性 | C. | SO2的漂白性 | D. | SO2的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
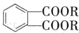 (代号DMP)是一种常用的酯类塑化剂,其相对分子质量为194.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其相对分子质量为194.工业上生产DMP的流程如图所示: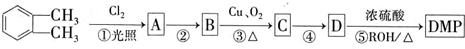
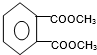 .
. .
.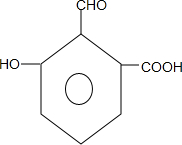 .
.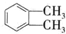 制备DMP的另一种途径:
制备DMP的另一种途径: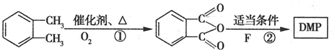
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
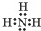 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com