
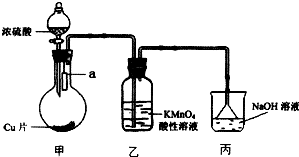
 实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质.
实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质.
| ||
| ||


科目:高中化学 来源: 题型:
| A、NH3易液化,液氨常用作制冷剂 |
| B、稀HNO3和活泼金属反应时很难得到氢气 |
| C、与金属反应时,稀HNO3可能被还原为更低价态,故稀HNO3氧化性强于浓HNO3 |
| D、铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酒精灯在不使用时,必须盖上灯帽 | ||
| B、不能直接用嘴吹灭酒精灯 | ||
C、酒精少于
| ||
| D、不能用酒精灯点燃另一酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
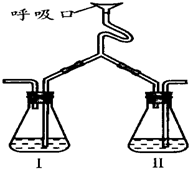 为验证人体呼出气体中含有的CO2不是来自空气,而是人体代谢作用产生的.某学校学生课外活动小组设计了如图所示装置(备注:通过呼吸口慢吸慢呼来实现),你认为该装置应选用的试剂是( )
为验证人体呼出气体中含有的CO2不是来自空气,而是人体代谢作用产生的.某学校学生课外活动小组设计了如图所示装置(备注:通过呼吸口慢吸慢呼来实现),你认为该装置应选用的试剂是( )| 瓶Ⅰ | 瓶Ⅱ | |
| A | Ca(OH)2 | NaOH |
| B | NaOH | NaOH |
| C | 稀HCl | Ca(OH)2 |
| D | NaOH | BaCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
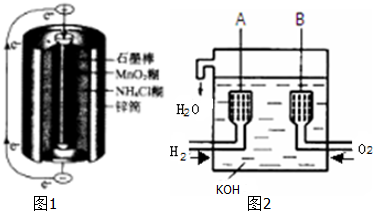
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com