
| A. | 无色溶液中:CO32-、Al3+、Cl-、NO3- | |
| B. | 无色溶液中:NH4+、K+、CH3COO-、Cl- | |
| C. | pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3- | |
| D. | 水电离的c(H+)=10-12 mol/L的溶液中:Fe3+、SO42-、K+、Na+ |
分析 A.碳酸根离子与铝离子发生双水解反应;
B.四种离子之间不反应,都是无色离子;
C.pH=1的溶液为酸性溶液,硝酸根离子在酸性条件下能够以后亚铁离子;
D.水电离的c(H+)=10-12 mol/L的溶液中存在大量氢离子或氢氧根离子,铁离子与氢氧根离子反应.
解答 解:A.CO32-、Al3+之间发生双水解反应,在溶液中不能大量共存,故A错误;
B.NH4+、K+、CH3COO-、Cl-之间不发生反应,且都是无色离子,在溶液中能够大量共存,故B正确;
C.pH=1的溶液中存在大量氢离子,Fe2+、NO3-发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.水电离的c(H+)=10-12 mol/L的溶液为酸性或碱性溶液,Fe3+与氢氧根离子反应,在碱性溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锌铁皮的镀层损坏后,铁更容易腐蚀 | |
| B. | 镀锡铁皮的镀层损坏后,铁更容易腐蚀 | |
| C. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| D. | 钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色试液加入Na2CO3溶液产生白色沉淀,结论:试液中含Ca2+ | |
| B. | 无色试液加入KOH溶液,加热产生的气体使湿润红色石蕊试纸变蓝,结论:试液中含NH4Cl | |
| C. | 无色试液使红色石蕊试纸变蓝,结论:试液呈碱性 | |
| D. | 无色试液焰色反应呈紫色,结论:试液是钾盐溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
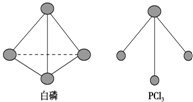 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 4.7 |
| 完成沉淀pH | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加入碘水,观察颜色反应 | B. | 分别加热,观察是否生成沉淀 | ||
| C. | 加入淀粉酶观察是否水解 | D. | 分别加入KI溶液,观察颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com