
【题目】某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据

(1)该反应的化学方程式为:______。
(2)反应开始至2min,用Z表示的平均反应速率为:______。
(3)下列叙述能说明上述反应达到化学平衡状态的是______(填序号):
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3molX,同时生成2molZ
D.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入amolX(g)和bmolY(g),发生反应X(g)+Y(g)═2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)?
①降低温度:_____ ②恒容通入氦气:_____③使用催化剂:______
【答案】3X+Y2Z 0.05mol/(Lmin) AB 减小 不变 增大
【解析】
根据图像可知,X、Y为反应物,2min时达到平衡状态,变化量为0.3mol、0.1mol,Z为生成物,变化量为0.2mol,变化量之比等于化学计量数之比,则计量数之比为3:1:2,方程式为3X+Y2Z。
(1)图像可知,X、Y、Z的变化量分别为0.3mol、0.1mol、0.2mol,则计量数之比为3:1:2,方程式为3X+Y2Z;
(2)v(Z)=c/t=0.2/(2×2)=0.05mol/(Lmin);
(3)A.反应体系中,可逆号两边气体计量数的和不相等,则反应达到平衡状态时,混合气体的总物质的量不随时间的变化而变化,符合题意,A正确;
B.反应体系中,可逆号两边气体计量数的和不相等,容器为恒容,若达到平衡状态时,混合气体的物质的量不再改变,则压强不随时间的变化而变化,符合题意,B正确;
C.反应自始至终,单位时间内每消耗3molX,同时生成2molZ,不能确定是否达到平衡状态,与题意不符,C错误;
D.反应体系中,所有物质均为气体,则混合气体的总质量一直不变,气体总质量不变不能判断是否达到平衡状态,与题意不符,D错误;
答案为AB;
(4)①降低温度导致活化分子数目减少,有效碰撞的几率降低,反应速率减小;
②恒容通入氦气,反应体系中的各量的浓度未发生变化,则反应速率不变;
③使用催化剂可降低反应的活化能,活化分子数目增多,有效碰撞几率增大,反应速率增大。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是
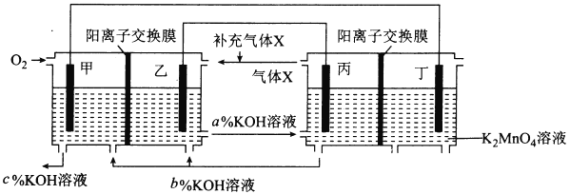
A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
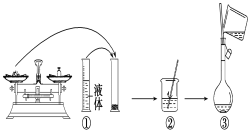
【题目】实验室需要480mL1 mol·L-1 NaOH溶液,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有____。
(2)下图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是____(填操作序号)。
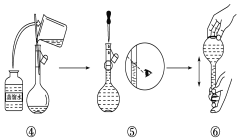
(3)称取NaOH固体时,所需砝码的质量为____(填写字母)。
A. 19.2g B. 20g C. 19.2g ~20g D. 大于20g
(4)在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的序号)___ 。
①称量 ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(5)下列操作会导致所配溶液的物质的量浓度偏高的是____。
A.配制NaOH溶液时,NaOH固体中含有Na2O杂质
B.用蒸馏水溶解NaOH固体后,立即转入容量瓶中定容
C.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出
D.定容时仰视刻度线
E.用托盘天平称量 NaOH 固体时,砝码生锈
F.配制前容量瓶中有少量水滴
(6)若某同学用密度为1.2g/cm3,质量分数为36.5%的浓盐酸配制100mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
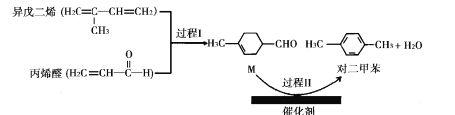
下列说法不正确的是
A.丙烯醛分子中所有原子可能共平面B.可用溴水鉴别异戊二烯和对二甲苯
C.对二甲苯的二氯代物有6种D.M能发生取代,加成,加聚和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A. 反应前5秒钟内,用NO表示的平均反应速率为0.lmol·L-1·s-1
B. 达到平衡后,升髙温度,正反应速率将减小,逆反应速率将增大
C. 达到平衡后,反应速率的关系有:V正(CO)=2v逆(N2)
D. 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硒形成的单质及其化合物有重要的科学研究价值,请回答下列问题:
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。基态氮原子的价电子轨道表示式为______________;其核外电子共占据____个能级;邻氨基吡啶的铜配合物中Cu2+的配位数是_______。

(2)高聚氮晶体结构如图所示,每个氮原子与另外三个氮原子结合形成空间网状结构。固态高聚氮是_______晶体;该晶体中n(N)与n(N—N)之比为_______;这种高聚氮N—N键的键能为160 kJ·mol-1,而N2的键能为942 kJ·mol-1,其可能潜在的应用是__________。

(3)NO3-的空间构型是________;HNO3的酸性比HNO2强,试从结构的角度解释其原因__________。
(4)硒有三种晶体(α单斜体、β单斜体和灰色三角晶),灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如图所示:

已知正六棱柱的边长为acm,高为bcm,阿伏加德罗常数的值为NA,则该晶体的密度为_____g·cm-3(用含NA、a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验Ⅰ |
|
实验Ⅱ | 取ⅰ中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反应的离子方程式是__。
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是__。
(3)①甲同学认为:实验Ⅱ观察到__现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
实验Ⅲ | 另取ⅰ中的黄色溶液少许,先③步骤步骤,,,,,加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
补做实验Ⅲ的目的是__。
(4)综合实验Ⅰ和Ⅲ,得出氧化性Cl2>Br2>I2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示)。下列有关说法正确的是 ( )

A.负极的电极反应式为Fe-3e-=Fe3+
B.钢铁生锈过程中电能转化为化学能
C.O2在正极参加反应生成OH-
D.为减缓铁制品生锈,可将其与铜相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯镍常用作加成反应的催化剂,制取原理:Ni(s)+4CO(g)![]() Ni(CO)4(g),实验室用如图所示装置制取Ni(CO)4,已知CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸:Fc(CO)5熔点-20℃,沸点103℃。回答下列问题:
Ni(CO)4(g),实验室用如图所示装置制取Ni(CO)4,已知CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸:Fc(CO)5熔点-20℃,沸点103℃。回答下列问题:

(1)装置A中发生反应的化学方程式为__________________。
(2)装置C用于合成Ni(CO)4(夹持装置略),最适宜选用的装置为__________________(填标号).
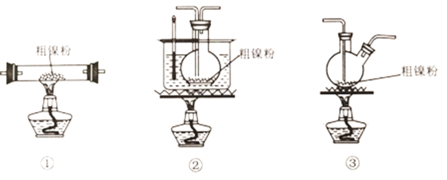
(3)实验过程中,必须先观察到__________________(填实验现象)才加热C装置,原因是__________________。
(4)制得的Ni(CO)4中常溶有Fe(CO)5等杂质,提纯的方法是__________________(填标号).
A.分液 B.过滤 C.蒸馏 D.蒸发浓缩、冷却结晶
(5)利用“封管实验“原理也可冶炼高纯镍。如图所示的石英玻璃封管中充有CO气体,则不纯的镍(Ni)粉应放置在封管的__________________温度区域端(填“323K”、“473K”)

(6)实验中加入6.90gHCOOH,C装置质量减轻1.18g(设杂质不参加反应,)E装置中盛有PdCl2溶液200mL.则PdCl2溶液的物质的量浓度至少为__________________molL-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com