
下列离子方程式正确的是
A、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ + 2I- = 2Fe2+ + I2
B、氧化铝溶解在NaOH溶液中:3H2O + Al2O3 + 2OH-?= 2[Al(OH)4]-?
C、硫酸铝溶液与氢氧化钡溶液反应,使SO42-恰好沉淀完全Al3+ + SO42-?+ Ba2+ + 3OH- = BaSO4 ↓ + Al(OH)3↓
D、在漂白粉配制成的溶液中通入SO2:Ca2+ + 2ClO- + SO2 + H2O = CaSO3↓+ 2HClO
B
【解析】
试题分析:A、Fe(NO3)3溶液中加入过量的HI溶液,则溶液中存在硝酸,硝酸氧化性大于铁离子,所以硝酸与碘离子发生氧化还原反应生成碘和NO、水,错误;B、氧化铝溶解在NaOH溶液中生成四羟基合铝酸钠,正确;C、硫酸铝溶液与氢氧化钡溶液反应,使SO42-恰好沉淀完全时,硫酸铝与氢氧化钡的物质的量之比是1:3,离子方程式是2Al3+ + 3SO42-?+3 Ba2+ + 6OH- = 3BaSO4 ↓ + 2Al(OH)3↓,错误;D、漂白粉的主要成分是次氯酸钠,次氯酸钠与二氧化硫发生氧化还原反应,生成硫酸根离子和氯离子,不会生成亚硫酸钙,错误,答案选B。
考点:考查离子方程式书写正误的判断


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.CO2的水溶液能导电,所以CO2是电解质
B.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
C.液溴不导电,所以溴是非电解质
D.BaSO4难溶于水,其水溶液的导电能力极弱,所以BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:填空题
(18分)
下图表示的化合物I的名称为甲基环氧乙烷,化合物I常用于制备药物和合成高分子材料。

(1)化合物I的分子式为______________。
(2)化合物I在催化剂作用下能与水发生反应得到二元醇,该反应的化学方程式为_______________。
(3)慢心律是一种治疗心律失常的药物,它的合成路线如下:
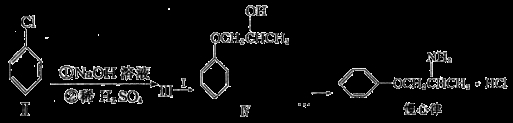
①III+I→Ⅳ的反应类型为__________________;III的结构简式为_________________。
②写出化合物III与浓溴水反应的化学方程式:___________________________________。
③由III和I制备Ⅳ的过程中有少量副产物V生成,V与Ⅳ互为同分异构体,V的结构简式为______________。
(4)已知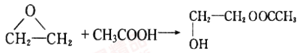 ,聚合物
,聚合物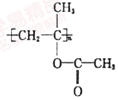 可用于制备高吸水性树脂,其单体的结构简式为__________________。以CH3COOH和化合物I为原料可合成该单体,涉及的反应的化学方程式为_______________、_________________。
可用于制备高吸水性树脂,其单体的结构简式为__________________。以CH3COOH和化合物I为原料可合成该单体,涉及的反应的化学方程式为_______________、_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A、取ag混合物充分加热,剩余bg固体
B、取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg
C、取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体
D、取ag混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得bg固体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
在标准状况下,将aLNH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为Cmol/L。下列叙述中正确的是
①ω=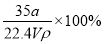
②C=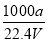
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为: c(Cl-) > c(NH4+) > c(H+) > c(OH-)
A、①④ B、②③ C、①③ D、②④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合试卷(解析版) 题型:填空题
(16分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、 、 ;其中玻璃棒的作用是 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是 。
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是 mol/L。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式 。
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是__________。(填编号)
a.NaOH溶液、酚酞试液
b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液
d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过 (填操作名称)制得硫酸锰晶体(MnSO4?H2O,相对分子质量为169)。已知废气中SO2浓度为8.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3燃煤尾气,可得到硫酸锰晶体质量为 kg(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合试卷(解析版) 题型:选择题
下列有关物质性质的描述和该性质的应用均正确的是
A.氨气具有氧化性,用浓氨水检验氯气管道是否泄漏
B.铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀
C.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气
D.二氧化锰具有较强的的氧化性,可作H2O2分解的氧化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列热化学方程式中的反应热下划线处表示燃烧热的是
A.NH3(g)+ O2(g)
O2(g) NO(g)+
NO(g)+ H2O(g); ΔH=-a kJ·mol-1
H2O(g); ΔH=-a kJ·mol-1
B.C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l); ΔH=-b kJ·mol-1
6CO2(g)+6H2O(l); ΔH=-b kJ·mol-1
C.2CO(g)+O2(g) 2CO2(g); ΔH=-c kJ·mol-1
2CO2(g); ΔH=-c kJ·mol-1
D.CH3CH2OH(l)+ O2(g)
O2(g) CH3CHO(l)+H2O(l);ΔH=-d kJ·mol-1
CH3CHO(l)+H2O(l);ΔH=-d kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一12月月考化学试卷(解析版) 题型:选择题
从铝土矿制备铝所涉及的下列有关反应中,属于氧化还原反应的是
A.铝土矿溶于NaOH溶液中 B.偏铝酸钠溶液的酸化
C.灼烧氢氧化铝固体 D.电解熔融的氧化铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com