

| A. | 浓硫酸能加快酯化反应速率 | B. | 不断蒸出酯,会降低其产率 | ||
| C. | 装置b比装置a原料损失的少 | D. | 可用分液的方法分离出乙酸乙酯 |
分析 A.制取乙酸乙酯时,需要加入浓硫酸做催化剂和吸水剂;
B.可逆反应,减少生成物浓度,有利于反应正向移动;
C.装置b采用水浴受热均匀,比装置a原料损失的少;
D.分离互不相溶的液体,可用分液的方法分离,乙酸乙酯不溶于饱和碳酸钠溶液,可用分液操作方法分离出乙酸乙酯和饱和碳酸钠溶液.
解答 解:A.乙酸与乙醇在浓硫酸作用下加热发生酯化反应,化学反应为:CH3COOH+C2H5OH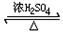 CH3COOC2H5+H2O,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动.故浓硫酸的作用为催化剂,吸水剂,浓硫酸能加快酯化反应速率,故A正确;
CH3COOC2H5+H2O,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动.故浓硫酸的作用为催化剂,吸水剂,浓硫酸能加快酯化反应速率,故A正确;
B.该制备乙酸乙酯反应为可逆反应,不断蒸出酯,减少生成物浓度,有利于反应正向移动,会提高其产率,故B错误;
C.乙醇、乙酸易挥发,甲装置则采取直接加热的方法,温度升高快,温度不易于控制,装置b采用水浴受热均匀,相对于装置a原料损失的少,故C正确;
D.分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,故D正确;
故选B.
点评 本题考查乙酸乙酯的制备,解答时须注意酯化反应的原理和饱和碳酸钠溶液的作用,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 甲池中负极反应为:N2H4-4e-═N2+4H+ | |
| B. | 甲池溶液pH不变,乙池溶液pH减小 | |
| C. | 反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗2.24L O2,此时乙池中理论上最多产生12.8g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料 | |
| B. | 绿色化学的核心是对环境产生的污染进行治理 | |
| C. | 氯化铵、二氧化硫溶于水都能导电,所以它们都属于电解质 | |
| D. | 云、烟、雾等均能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液pH>7 | |
| B. | 对混合溶液进行微热,K1增大、K2减小 | |
| C. | 调节混合溶液的pH至中性,则此时溶液中c(Na+)=c(CH3COO-) | |
| D. | 温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的简单气态氢化物的热稳定性比Y的强 | |
| B. | W的氧化物的水化物的酸性一定比X的强 | |
| C. | 半径r(W)>r(Z)>r(Y)>r(X) | |
| D. | Z与Y形成的两种常见化合物中,阴、阳离子个数比均为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com