
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 ,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体. .
. 分析 (1)同周期主族元素自左而右电负性增大、同主族自上而下电负性减小;
(2)同周期主族元素自左而右第一电离能呈增大趋势,Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(3)根据核外电子排布规律书写;
(4)水分子之间存在氢键,沸点高于硫化氢;
(5)二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,双键中含有1个σ键、1个π键,干冰属于分子晶体;
(6)反应热=反应物总键能-生成总键能,据此计算反应热书写热化学方程式;
(7)根据核外电子排布规律书写外围电子排布式,Fe失去4s能级2个电子及3d能级1个电子形成+3价阳离子.
解答 解:(1)同周期主族元素自左而右电负性增大、同主族自上而下电负性减小,故电负性:Si<C<N<O,
故答案为:硅<碳<氮<氧;
(2)同周期主族元素自左而右第一电离能呈增大趋势,Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Mg>Al>Na,
故答案为:Mg>Al>Na;
(3)Al元素核外电子排布式为1s22s22p63s23p1,N的外围电子排布式为2s22p3,
故答案为:1s22s22p63s23p1;2s22p3;
(4)水分子之间存在氢键,沸点高于硫化氢,
故答案为:H2O;水分子之间存在氢键;
(5)二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,电子式为 ,结构式为O=C=O,双键中含有1个σ键、1个π键,分子内σ键与π键的个数比为1:1,干冰属于分子晶体,
,结构式为O=C=O,双键中含有1个σ键、1个π键,分子内σ键与π键的个数比为1:1,干冰属于分子晶体,
故答案为: ;O=C=O;1:1;分子晶体;
;O=C=O;1:1;分子晶体;
(6)合成氨逆反应为:2NH3?N2+3H2,反应热△H=6×391kJ•mol-1-946kJ•mol-1-3×436kJ•mol-1=104kJ•mol-1,热化学方程式为:2NH3(g)?N2(g)+3H2(g)△H=+92kJ•mol-1,
故答案为:2NH3(g)?N2(g)+3H2(g)△H=+92kJ•mol-1;
(7)26号元素的核外电子排布为1s22s22p63s23p63d64s2,外围电子排布式为3d64s2?,Fe失去4s能级2个电子及3d能级1个电子形成+3价阳离子,外围电子排布为3d5,轨道排布图为 ,
,
故答案为:3d64s2; .
.
点评 本题考查元素周期律、核外电子排布、氢键、电子式、热化学方程式书写等,旨在考查学生对基础知识的掌握,注意同周期第一电离能异常情况.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水结成冰体积膨胀,密度变小 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| D. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜作阳极,镀件作阴极,溶液中含有铜离子 | |
| B. | 铁作阴极,镀件作阳极,溶液中含有铜离子 | |
| C. | 铁作阳极,镀件作阴极,溶液中含有亚铁离子 | |
| D. | 铜用阴极,镀件作阳极,溶液中含有锌离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液的浓度变为0.08 mol•L-1 | B. | 阳极上产生112 mL O2(标准状况) | ||
| C. | 转移的电子数是1.204×1022 | D. | 反应中有0.02 mol的Ag被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
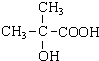 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com