
下列说法正确的是 ( )
A.离子化合物中一定不含共价键,共价化合物中一定不含离子键
B.含有离子键的化合物一定是离子化合物 C.含有共价键的物质一定是共价化合物
D.分子间作用力越大,分子的热稳定性就越大
| D | ||
| A | B | C |
| E |
科目:高中化学 来源: 题型:
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量的浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
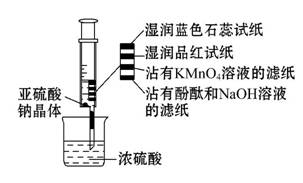
A.蓝色石蕊试纸先变红后褪色
B.沾有KMnO4溶液的滤纸褪色,证明了SO2的漂白性
C.品红试纸褪色,证明了SO2的漂白性
D.沾有酚酞和NaOH溶液的滤纸褪色,证明了SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,瑞士科学家库尔特、维特里希等人为此获得了诺贝尔化学奖。下列有关13C、15N的叙述正确的是 ( )
A.15N与14N互为同位素
B.13C与C60互为同素异形体
C.13C、15N具有相同的中子数
D.15N的核外电子数与中子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
)科学研究表明,月球上有丰富的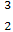 He资源,可开发利用作未来的新型能源。
He资源,可开发利用作未来的新型能源。
(1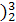 He的中子数是
He的中子数是 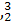 He与
He与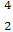 He互称为 。
He互称为 。
(2)α粒子是带有2个单位正电荷、质量数为4的原子核,由此推断α粒子含有
个质子和 个中子。
(3)在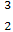 He
He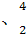 He两种核素中,原子核内的中子数之差为 ,与α粒子有相同质子数和中子数的是 。
He两种核素中,原子核内的中子数之差为 ,与α粒子有相同质子数和中子数的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于短周期元素,下列说法正确的是( )
A.若两元素原子序数相差8,则周期数一定相差1
B.两种简单离子不可能相差3个电子层
C.同族的两元素之间不可能形成化合物 D.最外层电子数相同的微粒一定位于同一族
查看答案和解析>>
科目:高中化学 来源: 题型:
主族元素W、X、Y、Z位于同一周期,原子序数依次增大,W、X是金属元素,Y、Z是非金属元素。W、X的最高价氧化物对应的水化物可以相互反应,W与Y可形成化合物W2Y,Y的最外层电子数是核外电子层数的2倍。下列说法正确的是( )
A.Y的气态氢化物比Z的气态氢化物稳定
B.W的最高价氧化物对应的水化物是最强的碱
C.Y的单质和氧气、氢气都能发生化合反应,且反应产物都具有还原性
D.W、X、Y、Z四种元素的原子半径由小到大的顺序是W<X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
我国在砷化镓太阳能电池研究方面国际领先.砷(As)和镓(Ga)都是第四周期元素,分别属于ⅤA和ⅢA族.下列说法中,不正确的是( )
|
| A. | 原子半径:Ga>As>P | B. | 热稳定性:NH3>PH3>AsH3 |
|
| C. | 酸性:H3AsO4>H2SO4>H3PO4 | D. | Ga(OH)3 可能是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17.请填空(用元素符号或化学用语):
(1)Y是 ,Z是 ,W是 ;
(2)Y元素的最高价氧化物的化学式是 ,其对应的水化物分子式是 ;
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1.该化合物的化学式 4,其中存在的化学键类型有 ;
(4)上述四种元素中,非金属性最强的是 ,非金属性最弱的是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com