
【题目】有三份白色固体分别为碳酸钠、碳酸氢钠及二者的混合物。某化学课外活动小组对其进行相关实验和探究。
I.甲组同学采用加热的方法确定其成分。
(1)除托盘天平、药匙、三脚架、泥三角、玻璃棒和干燥器外,完成本实验还需要的实验仪器有_________。
(2)该小组同学准确称取一定量的样品m1g,多次加热、冷却、称量直至恒重,质量为m2g。依据得出结论,请完成下表。
m2与m1的关系 | 结论 | |
① | 样品为Na2CO3 | |
② | 样品为NaHCO3 | |
③ | 样品为Na2CO3和 NaHCO3的混合物 |
II.乙组同学利用已鉴别出的NaHCO3和Na2CO3,继续进行实验,对于“能否用CaCl2鉴别的NaHCO3和Na2CO3”的问题进行探究。
(3)小组同学先将NaHCO3、Na2CO3、CaCl2固体分别配制成0.5mol/L的溶液。设汁如下实验方案:
表1
实验方案 | 预测现象 | |
实验1 | 向2mL Na2CO3溶液中滴加1mL CaCl2溶液 | 有白色沉淀生成 |
实验2 | 向2mL NaHCO3溶液中滴加1mL CaCl2溶液 | 无白色沉淀生成 |
若已知:①室温下,0.5mol/L NaHCO3溶液pH=8.5,溶液中c(HCO3-)=0.49 mol/L 。
②室温下, H2CO3的二级电离常数K2=5.6×10-11。
③Ksp(CaCO3)=2.8×10-9。
试估算使0.5mol/L NaHCO3溶液中的CO32-沉淀所需的c(Ca2+)应不低于_____mol/L,并由此得出结论:实验2的预测现象_____(填“正确”或“不正确”)。
⑷实际实验过程发现实验2的现象为白色沉淀并有无色气体生成。此现象对应的离子方程式为_____________。
(5)该小组同学继续设计实验对NaHCO3溶液与CaCl2溶液的反应进行探究,利用气体压力传感器得到的部分实验数据如下:(注:CaCl2溶液浓度相同)
表2 容器内气体浓度达到10000ppm所需时间
C(NaHCO3)/(mol/L) | 所需时间/s | |||
v(CaCl2):v(NaHCO3) | ||||
1:5 | 2:5 | 4:5 | 1:1 | |
1.0 | 142 | 124 | 114 | 156 |
0.5 | 368 | 264 | 244 | 284 |
0.25 | 882 | 450 | 354 | 632 |
0.1 | 1126 | 1316 | 816 | 1816 |
由实验数据可得出的结论是:
①当v(CaCl2):v(NaHCO3)一定时,随着_____,气体逸出速率减小;
②NaHCO3浓度在0.1~1.0mol/L,v(CaCl2)与v(NaHCO3)的比值为____时,气体逸出速率最快,可获得理想的实验观察效果。
【答案】 (铁)坩埚 酒精灯 坩埚钳(坩埚钳可不采分) ① m2 = m1 ②m2 = ![]() m1 ③
m1 ③![]() m1 < m2 < m1 1.0×10-6.5 不正确 2HCO3- + Ca2+ = CaCO3↓+ H2O + CO2↑ c(NaHCO3) 的减小 4:5
m1 < m2 < m1 1.0×10-6.5 不正确 2HCO3- + Ca2+ = CaCO3↓+ H2O + CO2↑ c(NaHCO3) 的减小 4:5
【解析】(1)本题考查实验仪器的选用,根据实验原理,需要采用加热方法,确定其成分,方法步骤是取用药品→称量→在坩埚中加热→干燥器中冷却(防止碳酸钠在空气中冷却,带有水)→称量,因此需要用到的仪器有药匙、托盘天平、坩埚、泥三角、三脚架、酒精灯、玻璃棒、坩埚钳、干燥器等;(2)本题考查成分的测定,①碳酸钠稳定,受热不易分解,因此m1=m2,说明样品为Na2CO3;②碳酸氢钠受热易分解,即2NaHCO3 ![]() Na2CO3+CO2+H2O,根据反应方程式,求出m2=53m1/84g,说明样品为NaHCO3;③当m2在①②之间,即
Na2CO3+CO2+H2O,根据反应方程式,求出m2=53m1/84g,说明样品为NaHCO3;③当m2在①②之间,即![]() m1 < m2 < m1,说明样品是Na2CO3和NaHCO3;(3)本题考查电离平衡常数和溶度积的计算,Ka2=c(H+)×c(CO32-)/c(HCO3-)=10-8.5×c(CO32-)/0.49=5.6×10-11,解得c(CO32-)=2.744×10-2.5mol·L-1,c(Ca2+)=Ksp/c(CO32-)=2.8×10-9/2.744×10-2.5mol·L-1=1×10-6.5mol·L-1;当所加c(Ca2+)> 1×10-6.5mol·L-1,有沉淀产生,故预测结论不正确;(4)本题考查根据实验现象得出结论,白色沉淀是CaCO3,气体是CO2,因此离子反应方程式为HCO3-+Ca2+=CaCO3↓+H2O+CO2↑;(5)考查从实验数据中得出结论,①根据表格数据,随着c(NaHCO3)的减小,气体逸出速率减小;②根据表格数据,时间越短,逸出速率越快,当v(CaCl2)与v(NaHCO3)的比值为4:5时,逸出速率最快。
m1 < m2 < m1,说明样品是Na2CO3和NaHCO3;(3)本题考查电离平衡常数和溶度积的计算,Ka2=c(H+)×c(CO32-)/c(HCO3-)=10-8.5×c(CO32-)/0.49=5.6×10-11,解得c(CO32-)=2.744×10-2.5mol·L-1,c(Ca2+)=Ksp/c(CO32-)=2.8×10-9/2.744×10-2.5mol·L-1=1×10-6.5mol·L-1;当所加c(Ca2+)> 1×10-6.5mol·L-1,有沉淀产生,故预测结论不正确;(4)本题考查根据实验现象得出结论,白色沉淀是CaCO3,气体是CO2,因此离子反应方程式为HCO3-+Ca2+=CaCO3↓+H2O+CO2↑;(5)考查从实验数据中得出结论,①根据表格数据,随着c(NaHCO3)的减小,气体逸出速率减小;②根据表格数据,时间越短,逸出速率越快,当v(CaCl2)与v(NaHCO3)的比值为4:5时,逸出速率最快。


科目:高中化学 来源: 题型:
【题目】A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:
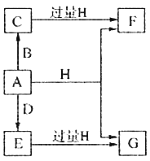
(1)A所含元素在周期表中的位置为______________,C的电子式为_______________。
(2)A与H在加热条件下反应的化学方程式为__________________。
(3)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为____________________。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为__________________。
(4)向含有0.4molF、0.1molG的混合溶液中加入过量盐酸,完全反应后收集到aL气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a=____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E是一种医药中间体,常用于制备抗凝血药,合成路线如下:

(1)A的结构简式为__________________________ ;
B中含氧官能团名称为______________、_______________;
(2)C转化为D的反应类型是_______________;
(3)写出D与足量NaOH溶液完全反应的化学方程式___________________________。
(4)1molE最多可与________molH2加成。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式 __________________;
A.能发生银镜反应 B.核磁共振氢谱只有4个峰
C.能与FeCl3溶液发生显色反应,水解时1mol可消耗3molNaOH
(6)已知工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。结合上述合成路线中有关信息,试写出以苯、甲苯为原料制取苯甲酸苯酚酯的合成路线流程图(无机原料任选)。合成路线流程图示例如下:
)是一种重要的有机合成中间体。结合上述合成路线中有关信息,试写出以苯、甲苯为原料制取苯甲酸苯酚酯的合成路线流程图(无机原料任选)。合成路线流程图示例如下:
![]() _________________________________________________________________________
_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某有机物A的分子中,具有酚羟基、醇羟基、羧基等官能团,其结构简式如图.
请同学们根据官能团
①A跟NaOH溶液反应的化学方程式是:
②A跟NaHCO3溶液反应的化学方程式是:
③A在一定条件下跟Na反应的化学方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.02mol铜片溶于100mL9mol/LHNO3中,产生336mL气体(只含NO、NO2)。该气体与一定量O2混合后用水恰好完全吸收,则通入的O2体积为(气体体积均为标准状况)( )
A. 22.4mL B. 33.6mL
C. 44.8mL D. 224mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于100ml1mol/LCaCl2溶液的叙述正确的是
A. Cl-的物质的量浓度为2mol/L
B. CaCl2的物质的量为1mol
C. 取出50 mL后,剩余溶液中CaCl2的物质的量浓度为0.5mol/L
D. 该溶液中水的体积为100 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示,下列叙述正确的是( ) 
A.M的相对分子质量是180
B.1mol M最多能与2mol Br2发生反应
C.M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4
D.1mol M与足量NaHCO3反应能生成2mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) △H>0。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H>0。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
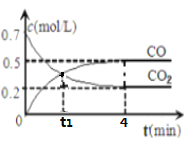
(1)t1时,正、逆反应速率的大小关系为ν正______ν逆(填“>”“<”或“=”);
(2)4分钟内,CO2的转化率为__________;CO的平均反应速率v(CO)=__________________;
(3)下列条件的改变能减慢其反应速率的是______________(选填序号)
①降低温度 ②减少铁粉的质量
③保持压强不变,充入He使容器的体积增大 ④保持体积不变,充入He使体系压强增大
(4)下列描述能说明上述反应已达平衡的是__________________(选填序号)
①v(CO2)=v(CO)
②单位时间内生成n molCO2的同时生成n mol CO
③ 容器中气体压强不随时间而变化
④容器中气体的平均分子量不随时间而变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com