
| n |
| V |
| 3.2g |
| 16g/mol |


 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������[��TiO��2��B2O5��?4H2O]��һ�ָ�Ч�����������Ӽ��������������Ѻ���ɰ����ҺΪԭ��ʪ���ϳɣ�
������[��TiO��2��B2O5��?4H2O]��һ�ָ�Ч�����������Ӽ��������������Ѻ���ɰ����ҺΪԭ��ʪ���ϳɣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��H+��NH4+��I-��NO3- |
| B��Na+��Ca2+��ClO-��HCO3-�� |
| C��K+��Mg2+��CO32-��SO42- |
| D��Hg2+��H+��Cl-��S2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���������еĻ�ѧ�� | �����֮�� | |
| ������� | N-N N-C N-H C-H |  |
| �˴Ź������� |  | 3��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� |
| �� |
| �� |
| �� |
| 1 |
| 2 |
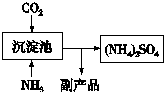
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
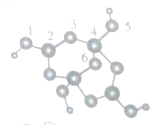
 ������Ԫ��A��B��C��D��E������A��B��C��D��Ԫ�����ڱ��е�λ����ͼ��ʾ��A��B��Cԭ�ӵ�����������֮��Ϊ17��E�Ƕ�������ԭ�Ӱ뾶��������Ԫ�أ���ش��������⣺
������Ԫ��A��B��C��D��E������A��B��C��D��Ԫ�����ڱ��е�λ����ͼ��ʾ��A��B��Cԭ�ӵ�����������֮��Ϊ17��E�Ƕ�������ԭ�Ӱ뾶��������Ԫ�أ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NaԪ�ص����ԭ������ |
| B��SԪ�ص����ԭ������ |
| C��OԪ�ص����ԭ������ |
| D��SeԪ�ظ�ͬλ�صķ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1mol/L NaHCO3��Һ��0.1mol/L NaOH��Һ�������ϣ�������Һ�У�C��Na+����c��CO32-����c��HCO3- ����c��OH-�� |
| B��20ml 0.1mol/L CH3COONa��Һ��10ml 0.1mol/L HCl��Һ��Ϻ���Һ�����ԣ�������Һ�У�C��CH3COO-����c��Cl-����c��CH3COOH����c��H+�� |
| C�������£�pH=2��������pH=12�İ�ˮ�������ϣ�������Һ�У�c��Cl-��+c��H+����c��NH4+ ����c��OH-�� |
| D��0.1mol/L CH3COOH��Һ��0.1mol/L NaOH��Һ�������ϣ�������Һ�У�c��OH-����c��H+��+c��CH3COOH�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com