
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是 ( )
A.1 molN2与4 mol H2反应生成的NH3分子数为2NA
B.1 molFe溶于过量硝酸,电子转移数为2NA
C.现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA
D.11.2 L标况下的SO3所含分子数为0.5NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】写出下列化学反应方程式:
(1)苯酚溶液中滴入浓溴水: 。
(2)乙醇制乙烯: 。
(3)溴乙烷与NaOH的乙醇溶液共热: 。
(4)将CO2通入苯酚钠溶液中: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,乳酸成为研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过发酵法制备。利用乳酸 ![]() 为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
(1)请写出乳酸分子中含氧官能团的名称 、 。
(2)乳酸能与纯铁粉反应制备一种补铁药物
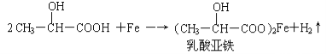 该反应中的还原剂是____________
该反应中的还原剂是____________
(3) 乳酸发生下列变化
![]()
所用的试剂是a ,b (写化学式)
(4)请写出下列反应的化学方程式,并注明反应类型:
①乳酸与乙醇的反应 ; 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液和Na2CO3溶液混合加热煮沸能产生CO2气体。下列说法中正确的是( )
A. NaHSO3溶液因水解而呈碱性
B. 两溶液混合后产生CO2的原因是二者发生相互促进的水解反应
C. 向NaHSO3溶液中加入三氯化铁溶液既有沉淀生成,又有气体生成
D. 0.1 mol·L-1的NaHSO3溶液中:c(HSO![]() )+2c(SO
)+2c(SO![]() )+c(OH-)-c(H+)=0.1 mol·L-1
)+c(OH-)-c(H+)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为_____________
(2)实验过程中,装置B、C中发生的现象分别是_______________、______________,这些现象分别说明SO2具有的性质是______和 。装置B中发生反应的离子方程式为_________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________。
(4)尾气可采用________溶液吸收。
(5)碳单质和浓硫酸会在加热时发生反应,写出反应化学方程式
除去CO2中含有的少量SO2可选择通过 溶液 。
(6)描述实验室稀释浓硫酸的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO4-+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:_______________________。
(2)反应中氧化剂是________;被氧化元素是__________;若有0.5 mol H2O2参加此反应,电子转移个数为____________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为________________________;这时若有0.5 mol H2O2发生分解,电子转移个数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池的工作原理如图所示。下列有关该电池说法正确的是( )

A.重油是石油分馏的产品,含有的主要元素为C、H、O
B.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
C.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
D.电池工作时,CO32-向电极B移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子酯为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为 。
(5)G中的官能团有 。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com