
【题目】某工厂排放的废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性小组利用这种废液来制取较纯净的氯化钾晶体及液溴,他们设计了如下的流程(提示:图中试剂a的作用是将Br-转化为Br2)
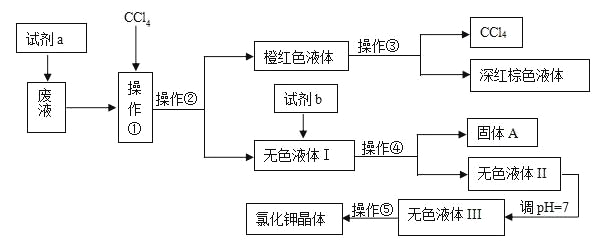
试剂b需要从以下试剂中选择:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、稀盐酸
(1)操作①②③④⑤的名称是________(填序号)。
A. 萃取、过滤、分液、过滤、蒸发结晶
B. 萃取、分液、蒸馏、过滤、蒸发结晶
C. 分液、萃取、过滤、过滤、蒸发结晶
D. 萃取、分液、分液、过滤、蒸发结晶
(2)除去无色液体Ⅰ中的Ca2+、Mg2+、SO42-,选出试剂b(试剂b代表一组试剂)所代表的试剂,按滴加顺序依次是_____________________________________________________________。
(3)调节pH=7的作用是________________________________________,所用的试剂是___________(填名称)
(4)操作⑤中用到的瓷质仪器名称是________________
【答案】BBaCl2溶液、饱和K2CO3溶液、KOH溶液(或KOH溶液、BaCl2溶液、饱和K2CO3溶液或BaCl2溶液、KOH溶液、饱和K2CO3溶液)除去过量的KOH和K2CO3稀盐酸蒸发皿
【解析】
由图示制备流程为:废液中加入双氧水,将溴离子氧化成溴单质,然后加入四氯化碳萃取、分液分离出溴,操作③蒸馏得到四氯化碳和溴单质;无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO42-,分别加入BaCl2、K2CO3、KOH溶液过滤后得到无色溶液Ⅱ和固体A,再调节溶液Ⅱ的pH除去碳酸根离子、氢氧根离子,得到无色溶液Ⅲ,最后蒸发结晶获得氯化钾固体。
(1)加入CCl4的目的是萃取;萃取后的操作是将有机层与水层分开,分液;从含有溴的CCl4溶液中分离得到CCl4和液溴的操作,是将两种相互混溶的液体进行蒸馏;操作④完成后得到固体A和无色液体I,分离固体和液体的操作是过滤;操作⑤是从溶液中得到能溶解于水的氯化钾晶体,是蒸发结晶;
(2)除去Ca2+,选用饱和K2CO3溶液;除去Mg2+,选用KOH溶液;除去SO42-,选用BaCl2溶液;
(3)无色液体Ⅱ中还含有杂质离子CO32-和OH-;用pH试纸测定至pH=7;
(4)操作⑤是蒸发结晶,需要使用的仪器为蒸发皿.
制备流程为:废液中加入双氧水,将溴离子氧化成溴单质,加入四氯化碳后萃取、分液分离出溴,通过操作③蒸馏得到四氯化碳和溴单质;无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO42-,分别加入BaCl2、K2CO3、KOH溶液过滤后得到无色溶液Ⅱ和固体A,再调节溶液Ⅱ的pH除去碳酸根离子、氢氧根离子,得到无色溶液Ⅲ,通过蒸发结晶获得氯化钾固体。
(1)由流程图知,无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO42-,无色液体Ⅲ中只含有K+、Cl-,则试剂b的作用是除去Ca2+、Mg2+、SO42-;操作①是萃取,操作②是分液,将互不相溶的两种液体分开,操作③是蒸馏,将沸点不同、互溶的两液体分开,操作④是过滤将溶液与沉淀分开,操作⑤是结晶,将KCl从其水溶液中提取出来,操作①、②、③、④、⑤的名称是:萃取、分液、蒸馏、过滤、蒸发结晶,则B正确,故选B;
(2)由于除杂时除杂试剂需过量,且不能引入新杂质,所以除去Ca2+,选用饱和K2CO3溶液;除去Mg2+,选用KOH溶液;除去SO42-,选用BaCl2溶液.而且只要满足BaCl2溶液在饱和K2CO3溶液之前加入即可,故滴加顺序依次为:BaCl2溶液、饱和K2CO3溶液、KOH溶液(或KOH溶液、BaCl2溶液、饱和K2CO3溶液或BaCl2溶液、KOH溶液、饱和K2CO3溶液);
(3)由以上知,无色液体Ⅱ中还含有杂质离子CO32-和OH-,需用盐酸来除去过量的OH-及CO32-,调节pH=7的操作方法是滴加盐酸,无气体产生时,用pH试纸测定至pH=7。
(4)由于操作⑤是蒸发结晶,所以该操作用到的瓷质仪器是蒸发皿。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:___________。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+ 的电子排布式为________________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3 价的元素是___________(填元素名称)。几种镧系元素的电离能(单位:kJ mol-1)
元素 | I1 | I2 | I3 | I4 |
Yb(镱) | 604 | 1217 | 4494 | 5014 |
Lu(镥) | 532 | 1390 | 4111 | 4987 |
La(镧) | 538 | 1067 | 1850 | 5419 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为________________(用元素符号表示)。
②写出氮的最简单气态氢化物水溶液中存在的氢键:__________________(任写一种)。
③元素Al 也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al 原子杂化方式为_____________,分子中所含化学键类型有______________(填字母)。
a.离子键 b.极性键 C.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有________个氧原子;已知晶胞参数为a pm,密度为ρ g· cm-3,NA=_____________ (用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X的最高价氧化物的化学式为XO3,X处于元素周期表中 ( )
A.第2周期第ⅡA族B.第2周期第ⅢA族
C.第3周期ⅣA族D.第3周期ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉溶液是一种胶体,并且淀粉遇到碘单质,可以出现明显的蓝色特征.现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中的液体进行下列实验,能证明半透膜完好无损的是( )
A.加入BaCl2溶液产生白色沉淀
B.加入碘水不变蓝
C.加入BaCl2溶液没有白色沉淀产生
D.加入碘水变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列说法错误的是
A.铝合金大量用于高铁建设B.活性炭具有除异味和杀菌作用
C.生石灰可用作袋装食品干燥剂D.光束通过云、雾会产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜、碱式氯化铜都是重要的无机杀菌剂及饲料中铜的添加剂。
I、碱式碳酸铜的制取:将小苏打配成溶液,先加入反应器中,于50℃时,在搅拌下加入精制的硫酸铜溶液,控制反应温度在70℃~80℃,反应以沉淀变为蓝绿色悬浊液为度,pH值保持在5左右,反应后经静置,沉降,用70℃~80℃蒸馏水洗涤,再用无水乙醇洗涤,再经离心分离、干燥,制得碱式碳酸铜成品。
(1)控制反应温度在70℃~80℃的方法是________________。
(2)控制pH在5左右的原因是______________。
(3)CuSO4溶液与NaHCO3溶液反应制取碱式碳酸铜的化学方程式为________________。
II.碱式氯化铜的制备有多种方法。
(4)如在45℃~50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,该反应的化学方程式为__________________。
也可采用CuCl2与石灰乳反应生成城式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反成有催化作用,其催化原理如图所示。M的化学式为_______________。

Ⅲ.如图探究实验I所制得的蓝绿色固体。

(5)B 装置的作用是________。C 中盛装的试剂应是_______。D装置加热前,需要如何操作?__________。
(6)若蓝绿色固体的组成xCuCO3·yCu(OH)2,实验能现察到的现象是__________。
(7)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有32 g某气体,摩尔质量为16 g·mol-1,则:
①该气体为___________ mol。
②该气体所含分子数为___________ NA。
③该气体在标准状况下的体积为_________ L。
(2) _________g H2O中的氧原子数目与标准状况下4.48 L CO2中的氧原子数目相同。
(3)同温同压下,同体积的氨气(NH3)和氧气的质量比是______,相同质量的氨气和氧气的体积比是_________;
(4)某元素1个原子的质量为a g,1 个 12C原子质量为b g,则该元素的这种原子的相对原子质量数值是_________或_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。

(1)步骤1的主要操作是__________,需用到的玻璃仪器除烧杯、玻璃棒外有________。
(2)步骤2中发生反应的化学方程式为___________________________
(3)步骤3中发生反应的化学方程式为___________________________
(4)步骤4中涉及的操作是:蒸发浓缩、_________、过滤、洗涤、烘干。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com