
| A、放热反应在常温下都能自发进行 |
| B、Fe3++3H2O?Fe(OH)3+3H+是吸热反应 |
| C、熵值大小关系为:S(冰)>S(水)>S(水蒸气) |
| D、对C(s)+H2O(g)?CO(g)+H2(g),多加些炭可以提高化学反应速率 |


科目:高中化学 来源: 题型:
| A、只有① | B、只有③④ |
| C、只有①③④ | D、全部都是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H>0,△S>0的反应任何条件都是非自发反应 |
| B、因N2(g)+3H2(g)?2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ |
| C、一定温度下,在固定体积密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,当v正(SO2)=v正(SO3)时,说明该反应已达到平衡状态 |
| D、H2标准燃烧热△H=-285.8 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z为0.3mol/L |
| B、Y2为0.1mol/L |
| C、X2为0.2mol/L |
| D、Z为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图,已知断裂1molN-N吸收167kJ热量,生成1mol N≡N放出942kJ热量.根据以上信息和数据,估算由N2气体生成1mol气态N4的△H为( )
罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图,已知断裂1molN-N吸收167kJ热量,生成1mol N≡N放出942kJ热量.根据以上信息和数据,估算由N2气体生成1mol气态N4的△H为( )| A、+441kJ?mol-1 |
| B、+882kJ?mol-1 |
| C、-441kJ?mol-1 |
| D、-882kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
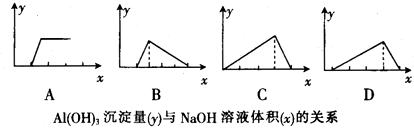
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com