
 (1)在25℃时,向100mL含HCl 14.6g的盐酸溶液里放入5.6g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末,收集到1.12L(标准状况)H2,又经过4min,铁粉完全溶解.则:
(1)在25℃时,向100mL含HCl 14.6g的盐酸溶液里放入5.6g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末,收集到1.12L(标准状况)H2,又经过4min,铁粉完全溶解.则:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
| 14.6g |
| 36.5g/mol |
| 5.6g |
| 56g/mol |
| ||
| 4min |
| c(CO)?c(H2O) |
| c(H2)?c(CO2) |
| ||
|
| K1 |
| K2 |
| K1 |
| K2 |
| K1 |
| K2 |


科目:高中化学 来源: 题型:
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
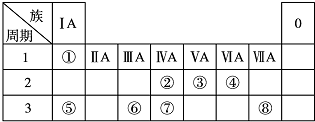


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)A、B两元素均位于周期表中第三周期,它们的原子核外最外层电子数之和为7,其中A元素的原子核外最外层电子数为1个,两者间可形成化合物A2B.根据以上条件回答下列问题:
(1)A、B两元素均位于周期表中第三周期,它们的原子核外最外层电子数之和为7,其中A元素的原子核外最外层电子数为1个,两者间可形成化合物A2B.根据以上条件回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和等体积上述氢氧化钠溶液,所需醋酸溶液的体积大于盐酸的体积 |
| B、当醋酸溶液和氢氧化钠溶液混合得到pH=7的溶液时,所得溶液中c(Na+)大于c(CH3COO-) |
| C、取等体积的上述盐酸和醋酸溶液,分别加入少量等质量且颗粒大小相同的锌粒,盐酸中锌粒先反应完 |
| D、25℃时,pH=2的盐酸、pH=2的醋酸溶液中水电离出的c(H+)均为10-12mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com