
【题目】完成下列各题:
现有下列七种物质:①液态氯化氢;②小苏打;③纯碱粉末;④葡萄糖;⑤氢氧化钾;⑥氢氧化铁胶体;⑦硫酸铁溶液;
(1)上述七种物质中,属于电解质的有_______,属于非电解质的有____。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为______________。
(3)除去③中少量②的方法是_______,化学方程式为________________。
(4)现有100mL⑦溶液中含Fe3+5.6g,则溶液中SO42-的物质的量浓度是______。
(5)若在⑥中缓慢加入①的水溶液,产生的现象是_____________________。
【答案】①②③⑤ ④ HCl+KOH=H2O+KCl 加热分解 2NaHCO3=Na2CO3+H2O+CO2↑ 1.5mol/L 先产生红褐色沉淀后沉淀溶解,溶液变黄色
【解析】
(1)电解质主要是酸、碱、盐、水、活泼金属氧化物;非电解质主要是大多数非金属氧化物、大多数有机物、非酸性气态氢化物;⑥⑦为混合物,既不是电解质也不是非电解质。
(2)离子方程式H++OH-=H2O体现出是强酸和强碱反应生成易溶于水的盐和水的反应;
(3) 碳酸钠性质稳定而碳酸氢钠受热易分解;
(4)先求出铁离子的物质的量,根据硫酸铁的组成可知溶液中硫酸根离子的物质的量,根据c=![]() 即可求出硫酸根物质的量浓度;
即可求出硫酸根物质的量浓度;
(5)氢氧化铁胶体加入盐酸后先发生聚沉,然后沉淀溶解于过量的酸中。
(1)电解质主要是酸、碱、盐、水、活泼金属氧化物,属于电解质的有①②③⑤;非电解质主要是大多数非金属氧化物、大多数有机物、非酸性气态氢化物,属于非电解质的有④;⑥⑦为混合物,既不是电解质也不是非电解质;故答案为:①②③⑤;④。
(2)离子方程式体现出是强酸和强碱反应生成易溶于水的盐和水的反应,该反应的化学方程式为HCl+KOH=H2O+KCl,故答案为:HCl+KOH=H2O+KCl。
(3)除去③中少量②的方法是小苏打受热分解变为碳酸钠,因此用加热方法,化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑,故答案为:加热方法;2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:加热方法;2NaHCO3![]() Na2CO3 + H2O + CO2↑。
Na2CO3 + H2O + CO2↑。
(4)现有100mL⑦溶液中含Fe3+5.6g即物质的量为0.1mol,根据硫酸铁的化学式Fe2(SO4)3可知,溶液中硫酸根离子的物质的量为0.15mol,则硫酸根物质的量浓度是![]() ,故答案为:1.5molL-1。
,故答案为:1.5molL-1。
(5)若在⑥中缓慢加入①的水溶液,胶体中加入电解质,先发生聚沉,再加入电解质HCl,由于是酸碱中和反应,沉淀又溶解,溶液变为黄色,故答案为:先产生红褐色沉淀后沉淀溶解,溶液变黄色。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】下面是同学们熟悉的物质:
①O2 ②H2O2 ③MgCl2 ④H2SO4 ⑤Na2CO3⑥NH4Cl ⑦CO2 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,只含有共价键的是__________________________________(填序号,下同);只含有离子键的是___________________________;既含有极性共价键又含有离子键的是_____________________________;既含有非极性共价键又含有离子键的是________________________不存在化学键的是_________________________________。
属于共价化合物的是_________________________________;
(2)写出下列物质的结构式
①O2 _______________②H2O2_______________⑦CO2_______________
(3)写出下列物质的电子式
⑥NH4Cl ______________⑨Na2O2 _______________ ⑩NaOH_______________
(4)用电子式表示下列物质的形成
①O2_______________________________________________________________
③MgCl2____________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需用500mL0.1mol/L的硫酸铜溶液,现选取500mL容量瓶进行配制,有关以下操作正确的是()
A.称取8.0g硫酸铜固体,加入500mL水
B.配制好的硫酸铜溶液应转移到细口试剂瓶中,并贴上标签
C.滴加蒸馏水不慎超过刻度线,立即用胶头滴管将多余的液体
D.定容摇匀后,发现配制溶液液面低于刻度线,应用胶头滴管滴加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.足量MnO2和100mL6mol/L浓盐酸反应产生Cl2的分子数为0.15NA
B.100mL1molFeCl3溶液中所含Fe3+的数目为0.1NA
C.48g正丁烷和10g异丁烷的混合物中碳碳单键的数目为3NA
D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)与氮、磷同一主族,可以形成As4、As2S3、As2O5、H3AsO3、H3AsO4等物质,有着广泛的用途。回答下列问题:
(1)As原子最外层电子的电子云伸展方向有___种。黄砷(As4)与白磷(P4)的结构类似,以下关于黄砷与白磷的比较叙述正确的是___(填编号)。
A.黄砷的熔点高于白磷 B.黄砷中共价键键能大于白磷
C.黄砷分子极性大于白磷 D.分子中共价键键角均为109°28′
(2)As元素的非金属性比N弱,用原子结构的知识说明理由。___。
(3)298K时,将20mL3xmol/LNa3AsO3、20mL3xmol/LI2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
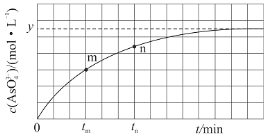
①若平衡时,pH=14,该反应的平衡常数为___。
②当反应达到平衡时,下列选项正确的是__(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.![]() 不再变化 d.c(I-)=ymol/L
不再变化 d.c(I-)=ymol/L
③tm时,v正__v逆(填“大于”“小于”或“等于”)。
④tm时,v逆__tn时v逆(填“大于”“小于”或“等于”),理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是
5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是

A. b点时,CO的转化率为20%
B. 容器内的压强保持恒定,表明反应达到平衡状态
C. b点和d点的化学平衡常数:Kb>Kd
D. 0到0.5min反应速率v(CO)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列3种有机化合物A:CH2=CH2、B:![]() 、C:CH3COOH。
、C:CH3COOH。
(1)写出化合物A、C中官能团的名称:___________、_______。
(2)3种化合物中能使溴的四氯化碳溶液褪色的是______(写名称),该反应的化学方程式为____。该物质在农业上用作水果的________。
(3)B的名称是_______,它的分子具有______(填分子构型)结构,是否存在单双键交替结构?___(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和H。已知A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。H是一种比水轻的油状液体,H仅由碳氢两种元素组成,H不能使酸性KMnO4溶液褪色,其碳元素与氢元素的质量比为12:l,H的相对分子质量为78。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)D中所含官能团的名称是_________________;
(2)写出反应③的化学方程式_______________________________________;
(3)G是一种高分子化合物,可以用来制造农用薄膜材料等,其结构简式__________;
(4)在体育竞技比赛中,当运动员肌肉挫伤或扭伤时,随队医生立即对准其受伤部位喷射物质F(沸点12.27℃)进行应急处理。写出由A制备F的化学方程式:___________;
(5)下列关于B的一种同系物甲醇的说法不正确的是___________(填字母)。
a.甲醇的结构简式为CH3OH,官能团为—OH
b.甲醇完全燃烧后的产物为CO2和H2O
c.B与甲醇都极易溶于水,是因为它们都能与水分子间形成氢键
d.甲醇与钠反应可以产生氢气,所以甲醇显酸性
(6)等质量的A、H完全燃烧时消耗O2的物质的量_______(填“A>H、A<H或A=H”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下4组实验,如图Ⅰ~Ⅳ所示。
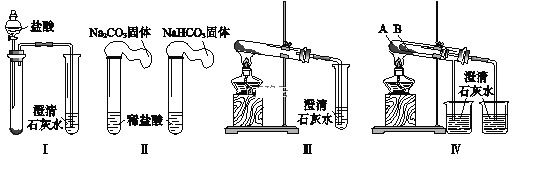
(1)Ⅱ所示的实验,若固体质量相同且稀盐酸足量时,气球鼓起较小的是____________(填化学式)。
(2)Ⅲ、Ⅳ所示的实验均能鉴别这两种物质,相关反应的化学方程式是_________________________和___________________________________________________。
(3)与Ⅲ相比,IV的优点是________________(填字母)。
a.Ⅳ比Ⅲ复杂 b.Ⅳ比Ⅲ安全 c.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(4)若用Ⅳ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体应该是_________(填化学式)。
(5)将适量钠投入下列溶液中,既能产生大量气体又能生成沉淀的是________________ (填字母)
a.稀硫酸 b.碳酸氢钙溶液 c.氯化镁溶液 d.硫酸铜溶液 e.饱和氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com