【答案】
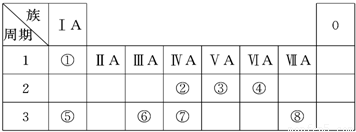
分析:由元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl,
(1)地壳中含量居于第二位的元素为Si元素;
(2)同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,最高价含氧酸的酸性减弱;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物为氢氧化钠、次氯酸钠、过氧化钠等;
(4)表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,该化合物为H
2O
2,二氧化锰、铁离子、铜离子都可以作为过氧化氢分解的催化剂;
(5)W与④是相邻的同主族元素,则W为S元素,H
2SO
3的具有氧化性、还原性、酸性、不稳定性等,据此写出相应的化学方程式;
(6)M是仅含非金属的盐所以一定是铵盐,⑥为Al元素,所以推断N是氧化铝,故Z是氢氧化铝,分析产物结合反应:X+Y+H
2O→Al(OH)
3+NH
4+ 可知,该反应为铝盐和一水合氨的反应,据此解答.
解答:解:由元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl,
(1)地壳中含量居于第二位的元素为Si元素,处于周期表中第三周期第IVA族,故答案为:第三周期第IVA族;
(2)同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,最高价含氧酸的酸性减弱,故酸性碳酸>硅酸,
故答案为:同一主族元素从上到下原子核外电子层数依次增多;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物为氢氧化钠、次氯酸钠、过氧化钠等,电子式为

等,
故答案为:

;
(4)表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,该化合物为H
2O
2,二氧化锰、铁离子、铜离子都可以作为过氧化氢分解的催化剂,
故答案为:c;
(5)W与④是相邻的同主族元素,则W为S元素,H
2SO
3的具有氧化性、还原性、酸性、不稳定性等,可以被强氧化剂氧化,如H
2SO
3+Br
2+2H
2O=H
2SO
3+2HBr,与NaOH发生中和反应H
2SO
3+2NaOH=Na
2SO
3+2H
2O,
故答案为:
| 编号 | 性质 | 化学方程式 |
| 示例 | | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 | H2SO3+Br2+2H2O=H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH=Na2SO3+2H2O |
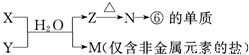
(6)M是仅含非金属的盐所以一定是铵盐,⑥为Al元素,所以推断N是氧化铝,故Z是氢氧化铝,分析产物结合反应:X+Y+H
2O→Al(OH)
3+NH
4+ 可知,该反应为铝盐和一水合氨的反应,
X溶液与Y溶液反应的离子方程式Al
3++3NH
3+3H
2O=Al(OH)
3↓+3NH
4+;
N→⑥的单质的化学方程式为2Al
2O
3(熔融)

4Al+3O
2↑;
M为氯化铵或硝酸铵等,溶液中NH
4+离子水解,破坏水的电离平衡,水溶液显酸性,故离子浓度c(Cl
-)>c(NH
4+)>c(H
+)>c(OH
-)或c(NO
3-)>c(NH
4+)>c(H
+)>c(OH
-);
M中阳离子的鉴定方法为:取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子,
故答案为:Al
3++3NH
3+3H
2O=Al(OH)
3↓+3NH
4+;2Al
2O
3(熔融)

4Al+3O
2↑;c(Cl
-)>c(NH
4+)>c(H
+)>c(OH
-)或c(NO
3-)>c(NH
4+)>c(H
+)>c(OH
-);取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
点评:本题考查无机物的推断及元素周期律、元素周期表、常用化学用语、盐类水解、元素化合物性质、实验方案设计等,元素及物质的推断是解答本题的关键,注重对高考常考考点的考查,对学生能力要求较高,题目难度中等.

 等,
等, ;
; 4Al+3O2↑;
4Al+3O2↑; 4Al+3O2↑;c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-);取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
4Al+3O2↑;c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-);取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.

 阅读快车系列答案
阅读快车系列答案














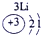
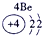
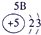
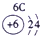
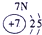
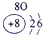
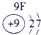
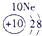
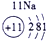





 表示的是
表示的是