

| A. | a电极是该电池的负极,发生氧化反应 | |
| B. | b电极反应式为2NO3-+10e-+12H+═N2↑+6H2O | |
| C. | 电池工作时,H+由左室通过质子交换膜进入右室 | |
| D. | 转化室中发生反应后溶液的pH增大(忽略体积变化) |
分析 该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物生成二氧化碳,据此分析解答.
解答 解:A、根据以上分析,a电极为该电池的负极,发生氧化反应,故A正确;
B、则右边装置中电极b硝酸根离子得电子发生还原反应是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,故B正确;
C、电池工作时,H+由负极左室通过质子交换膜进入正极右室,故C正确;
D、由装置图可知,转化室中铵根、氮气、氧气发生反应生成硝酸根和氢离子,所以发生反应后溶液的pH减小,故D错误;
故选D.
点评 本题考查化学电源新型电池,题目难度中等,侧重考查学生获取信息、分析推断能力,根据N元素化合价变化确定正负极,难点是电极反应式的书写,且原电池和电解池原理是高考高频点,要熟练掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳性依次减弱 | |
| B. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| C. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
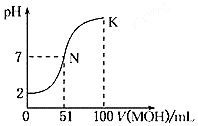 常温下,向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计).下列说法中正确的是( )
常温下,向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计).下列说法中正确的是( )| A. | 该滴定过程可选择酚酞作为指示剂 | |
| B. | HA的电离方程式为:HA?H++A- | |
| C. | K点溶液中:c (MOH)+c(OH-)-c(H+)=0.01mol•L-1 | |
| D. | N点水的电离程度大于K点水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
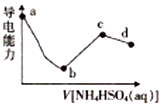 向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示.下列说法正确的是( )
向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示.下列说法正确的是( )| A. | b点溶液中只存在H2O的电离平衡和BaSO4的沉淀溶解平衡 | |
| B. | c 点滚液中:c(H+)+c(NH4+)=c(NH3•H2O)+c(OH-) | |
| C. | ab段反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | bc段之间存在某点,其溶液中:c(NH4+)=2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| B. | 检验铵盐方法:加氢氧化钠溶液,加热,用蘸有浓硫酸的玻璃棒靠近瓶口 | |
| C. | .制取硝酸铝方法:用AlCl3溶液和氨水反应,过滤得沉淀,再加稀HNO3 | |
| D. | 等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,后者放出的CO2多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com