
消除汽车尾气是减少城市空气污染的热点研究课题。
(1)汽车内燃机工作时发生的反应N2(g) + O2(g) 2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
①5 min内该反应的平均速率ν(NO) = ;在T ℃时,该反应的平衡常数K = 。
② 反应开始至达到平衡的过程中,容器中下列各项发生变化的是 (填序号)。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(2)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) ? △H =" —180.5" kJ·mol-1
2H2O(l) =2H2(g) + O2(g) ?△H =" +571.6" kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是
。
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g) + 2CO(g)
 2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
① 该反应的?H 0 (填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在右图中画出c(NO) 在T1、 S2 条件下达到平衡过程中的变化曲线(并作相应标注)。
(16分)
(1)(共9分)① 0.2 mol·L-1·min-1(2分) 1.25(3分) ② c d(4分)
(2)(共3分)2H2(g) + 2NO(g)=N2(g) + 2H2O(l) ?△H = -752.1 kJ·mol-1
(3)(共4分)① <(2分)
②(2分)见图: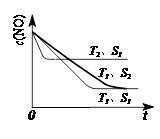
解析试题分析:(1)①由于c=n/V,各组分变化浓度之比等于系数之比,由此推断该反应体系中各组分的(起始、变化、平衡)浓度,则:
N2(g) + O2(g) 2NO(g)
2NO(g)
起始浓度(mol/L) 1.3 1.5 0
变化浓度(mol/L) 0.5 0.5 1
平衡浓度(mol/L) 0.8 1.0 1
根据平均反应速率的定义式,v(NO)=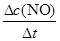 =
=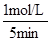 =0.2mol/(L?min)
=0.2mol/(L?min)
根据化学平衡常数的定义式,K=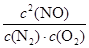 =
=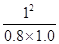 mol2/L2≈1.25
mol2/L2≈1.25
②混合气体的密度等于混合气体总质量除以容器体积,由于该反应各组分都是气体,所以混合气体总质量始终保持不变,容器体积始终为5L,因此混合气体密度始终保持不变,且密度不变不能说明达到平衡,故a错误;由于N2(g)+ O2(g) 2NO(g)的正反应是气体物质的量保持不变的反应,则混合气体总的物质的量始终不变,且容器内混合气体的压强始终不变不能说明达到平衡,故b错误;从反应开始达到平衡,反应物浓度逐渐减小,所以正反应速率逐渐减小,故c正确;单位时间内,N2和NO的消耗量之比就是正反应速率和逆反应速率之比,反应开始时,正反应速率最大、逆反应速率最小,此时N2和NO的消耗量之比最大,反应达到平衡时,正反应速率=逆反应速率,此时N2和NO的消耗量之比最小(为1/2),故d正确;
2NO(g)的正反应是气体物质的量保持不变的反应,则混合气体总的物质的量始终不变,且容器内混合气体的压强始终不变不能说明达到平衡,故b错误;从反应开始达到平衡,反应物浓度逐渐减小,所以正反应速率逐渐减小,故c正确;单位时间内,N2和NO的消耗量之比就是正反应速率和逆反应速率之比,反应开始时,正反应速率最大、逆反应速率最小,此时N2和NO的消耗量之比最大,反应达到平衡时,正反应速率=逆反应速率,此时N2和NO的消耗量之比最小(为1/2),故d正确;
(2)根据盖斯定律,已知的前一个热化学方程式减去后一个热化学方程式,可以得到:2H2(g) + 2NO(g)=N2(g) + 2H2O(l) ?△H = -752.1 kJ·mol-1;(3)读图,两条曲线先后达到平衡,说明T2>T1,即升高温度,平衡时c(NO)增大,由于升温平衡向吸热方向移动,c(NO)增大说明平衡向逆反应方向移动,则逆反应是吸热反应,所以正反应是放热反应,△H<0;画图要点:S1变为S2,即减小催化剂表面积,反应速率减小,单位时间内NO的变化浓度减小,则T1、S2的曲线位于T1、S1曲线的右边;催化剂不能使平衡移动,所以NO的平衡浓度与T1、S1曲线相同,只是达到平衡的时间比T1、S1曲线增大。
考点:考查化学反应原理,涉及求平均反应速率、化学平衡常数、化学平衡的建立、盖斯定律、热化学方程式、放热反应、吸热反应、画催化剂对反应速率和平衡移动的影响曲线。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:问答题
(14分)研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 = +489.0 kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0 (填“>”、“<”或“=”)。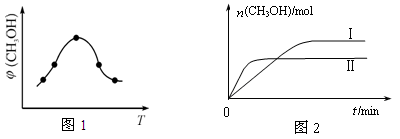
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。
当氨碳比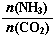 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(8分)某温度时,在0.5L密闭容器中某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得:
(1)该反应的化学方程式为______________________________。
(2)反应开始至4min时,B的平均反应速率为____________。
(3)平衡时A的转化率为________。第4min时,正逆反应速率的大小关系为:υ(正)___υ(逆)(填“>”、“<”或“=”,下同),第8min时,υ(正)___υ(逆)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
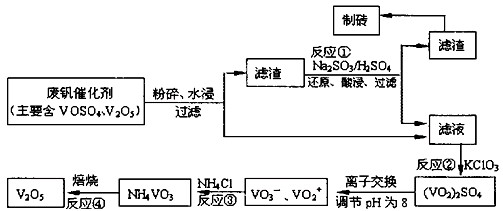
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺。己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
 2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为
2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为 。
。 2SO3(g) 的平衡常数为_____;
2SO3(g) 的平衡常数为_____;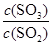 增大的是_____。
增大的是_____。查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)  2NH3(g) 在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。试求:(写出解题过程)
2NH3(g) 在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。试求:(写出解题过程)
(1)该温度下,反应的平衡常数是多少?
(2)H2的起始浓度;
(3)用N2表示该反应的反应速率是多少;
(4)N2的转化率(保留三位有效数字);
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为: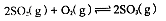 ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题: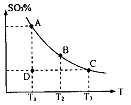
①反应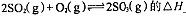 0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度 (填“增大”、“减小”或“不变”)。
0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度 (填“增大”、“减小”或“不变”)。
②若温度为T1、 T2,反应的平衡常数分别为K1、K2 则K1 K2(填“>”、“<”或“=”),反应进行到D点状态时,V正 V逆(填“>”、“<”或“=”)
③在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10 mol O2,在500℃开始反应,半分钟达到平衡,测得容器内含SO3 0.18 mol,则v(O2)= mol·L-1·min-1,若继续通入0.20 mol SO2和0.10 mol O2,平衡发生了移动,再次达到平衡后, mol<n(SO3)< mol.
(2)已知三种无色溶液:a.NaHCO3溶液,b.AlCl3溶液,c.NaAlO2溶液,它们两两反应均能生成Al(OH)3沉淀。请回答下列问题:
①两种溶液恰好完全反应,所得溶液中c(OH—)=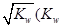 是水的离子积),则这两种溶液可为 (填字母)。
是水的离子积),则这两种溶液可为 (填字母)。
②能体现出NaHCO3在反应中,HCO—3的水解程度小于电离程度的离于方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 (4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)
(4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:
2NO+2CO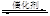 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | | | | | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | | | 80 |
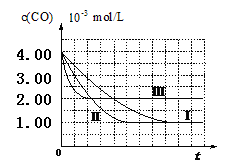
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属质量/g | 金属状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 2 | 0.10 | 块状 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 块状 | 1.0 | 50 | 20 | 35 | 125 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com