
【题目】可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(在下列空白中填写分离提纯的合理方法的序号及装置下合理的选项)。

(1)除去石灰水中悬浮的CaCO3颗粒:________。
(2)提纯氯化钠溶液中的氯化钠:___。
(3)分离汽油和煤油的混合物:______。
(4)分离水和苯的混合物:___。
科目:高中化学 来源: 题型:
【题目】海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是_____(填物理变化、化学变化);
(2)从海水中可获得大量的氯化钠,精制盐水时要除去SO42﹣、Mg2+、Ca2+,可依次加入稍过量的溶液是NaOH、_____、_____(写化学式),过滤后,再加入盐酸,蒸发溶液后可得到较纯净的氯化钠。
(3)食盐水能导电,是因为NaCl能电离出Na+和Cl﹣,它们的电子式分别为_____和_____,工业上利用电解饱和食盐水可制得重要化工产品,该反应的化学方程式_____
(4)氢气用途广泛,完全燃烧4g氢气就能烧开一壶水,在标准状况下,这些氢气的体积是_____L,含_____个氢原子。
(5)将制得的氯气通入石灰乳中可以制得漂粉精,其中有效成份为_____(写名称),漂粉精可用于游泳池中水的消毒,原因是(用化学方程式表示):_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参照反应Br+H2 ![]() HBr+H的反应历程示意图,下列叙述中正确的是
HBr+H的反应历程示意图,下列叙述中正确的是

A. 该反应的反应热△H=E2﹣E1
B. 正反应为吸热反应
C. 吸热反应一定要加热后才能发生
D. 升高温度可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl﹣、Mg2+、Ba2+、CO32﹣、SO42﹣,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.03mol(已知OH—+NH4+![]() NH3↑+H2O)
NH3↑+H2O)
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测不正确的是( )
A.K+一定存在B.100mL溶液中含0.01molCO32﹣
C.Cl﹣可能存在D.Ba2+和Cl﹣一定不存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银铜合金切割废料中回收银并制备铜化工产品的工艺如下:

注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为___________。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为___________(写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为______________________。
(4)过滤操作需要的玻璃仪器除烧杯外还有___________。
(5)固体混合物B的组成为___________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________。
(6)煅烧阶段通入惰性气体的原因___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是

A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,还可利用CO2据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。
(1)利用CO2和H2反应合成甲醇的原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)/% | 10 | 20 | 30 | 4b | 50 | 60 | 70 | 80 | 90 |
CH3OH的产率 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为________催化效果最佳。
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)
CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)

A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)①在1L的恒定密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示,则压强P2________P1(填“>”、“<”或“=”);平衡由A点移至C点、D点移至B点,分别可采取的具体措施为________、________;在c点时,CO的转化率为________。
②甲和乙两个恒容密闭容器的体积相同,向甲中加入1molCO和2molH2,向乙中加入2molCO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)________2P(L);平衡常数:K(M)________K(L)。(填“>”、“<”或“=”)

(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液分别加到HA、HB两种弱酸溶液中,两溶液中pH与粒子浓度比值的对数关系如图所示,已知pK=-lgKa。下列有关叙述错误的是
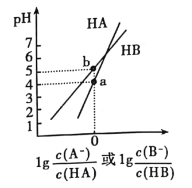
A. HA、HB两种酸中,HB的酸性弱于HA
B. b点时,c(B—)=c(HB)>c(Na+)>c(H+)>c(OH—)
C. 同浓度同体积的NaA和NaB溶液中,阴离子总数相等
D. 向HB溶液中加入NaOH溶液所得的混合溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )

A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com