
| A、锌为正极,Ag2O为负极 |
| B、锌为负极,Ag2O为正极 |
| C、原电池工作时,负极区溶液pH增大 |
| D、原电池工作时,溶液中K+向负极移动 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 |
| B、同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不相等 |
| C、将SO2气体通入BaCl2溶液中至饱和,未见沉淀生成,继续通入NO2则有沉淀生成 |
| D、除FeCl2溶液中的少量FeCl3,可用加入足量铁屑过滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
- 3 |
- 3 |
A、氧化能力:ClO
| ||||
| B、还原能力:Fe2+>I->Cl- | ||||
C、反应ClO
| ||||
D、氧化能力:BrO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、②④ | C、①③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
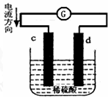
| A、电池工作的过程中,d电极上产生气泡 |
| B、电池工作时,溶液中SO42-向d移动 |
| C、c为负极,发生氧化反应 |
| D、电池工作完成后,溶液中SO42-浓度基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨溶于水的喷泉实验,说明氨气极易溶于水 |
| B、常温下,将铜放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中钝化 |
| C、浓硝酸久置显黄色,说明浓硝酸具有不稳定性 |
| D、向胆矾中加入浓硫酸后出现白色的现象,说明浓H2SO4具有吸水性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com