
是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]。
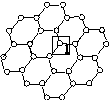

(a)石墨烯结构 (b)氧化石墨烯结构
(1)图(a)中,1号C与相邻C形成σ键的个数为________。
(2)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
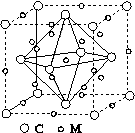
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
(1)3
(2)sp3 <
(3)O、H
(4)12 M3C60
[解析] (1)由图(a)可知,1号C与另外3个碳原子形成3个σ键。(2)图(b)中1号C与3个碳原子、1个氧原子共形成4个σ键,其价层电子对数为4,C的杂化方式为sp3;该C与相邻C的键角约为109°28′,图(a)中1号C采取sp2杂化,碳原子间夹角为120°。(3)氧化石墨烯中“—OH”的O可与H2O中的H形成氢键、氧化石墨烯中“—OH”的H可与H2O中的O形成氢键,氧化石墨烯中可与H2O形成氢键的原子有O、H。(4)利用“均摊法”可知该晶胞棱上12个M完全属于该晶胞的M为12×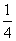 =3,位于晶胞内的9个M完全属于该晶胞,故该晶胞中M原子的个数为12;该晶胞中含有C60的个数为8×
=3,位于晶胞内的9个M完全属于该晶胞,故该晶胞中M原子的个数为12;该晶胞中含有C60的个数为8×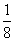 +6×
+6×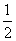 =4,因此该晶胞的化学式为M3C60。
=4,因此该晶胞的化学式为M3C60。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
如图所示三个烧瓶中分别装入含酚酞的0.01 mol/L CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
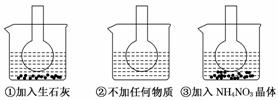
(1)含酚酞的0.01 mol/L CH3COONa溶液显浅红色的原因为_______________________
________________________________________________________________________。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是________。
A.水解反应为放热反应
B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量
D.NH4NO3溶于水时吸收热量
(3)向0.01 mol/L CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平 衡移动的方向分别为________、________、________、________(填“左”、“右”或“不移动”)。
衡移动的方向分别为________、________、________、________(填“左”、“右”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案能达到预期目的的是
①实验室保存FeCl3溶液应加少量稀盐酸,并且放入少量的铁粉 ②氢氧化钠溶液保存在配有橡胶塞的细口瓶中 ③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO ④用丁达尔效应可以区分食盐水和淀粉溶液 ⑤工业上可用金属铝与V2O5在高温下冶炼矾,铝作还原剂
④用丁达尔效应可以区分食盐水和淀粉溶液 ⑤工业上可用金属铝与V2O5在高温下冶炼矾,铝作还原剂
A.①②④ B.①②⑤
C.②④⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol/L)如图所示。

(1)pH=3时溶液中铜元素的主要存在形式是__________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH______________。
A.<1 B. 4左右 C.>6
4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“ 能”或“不能”)通过调节溶液pH的方法来除去,理由是
能”或“不能”)通过调节溶液pH的方法来除去,理由是
_________________________________________________________________。
(4)已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | CuS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 |
| 物质 | PbS | HgS | ZnS |
| Ksp | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题;
(1)b、c、d中第一电离能最大的是________(填元素符号),e的价层电子轨道示意图为________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为______;分子中既含有极性共价键、又含有非极性共价键的化合物是________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是________;酸根呈三角锥结构的酸是________。(填化学式)
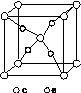
(4)e和c形成的一种离子化合物的晶体结构如图(a),则e离子的电荷为________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构[如图(b)所示]。
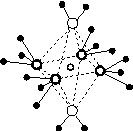
(a) (b)
该化合物中,阴离子为________,阳离子中存在的化学键类型有________;该化合物加热时首先失去的组分是________,判断理由是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
电子层数相同的三种元素X、Y、Z,已知最高价氧化物对应水化物的酸性HXO4 、H2YO4、H3ZO4,则下列判断错误的是 ( )
A.原子半径X>Y>Z
B.气态氢化物的稳定性HX>H2Y>ZH3
C.非金属性X>Y>Z
D.气态氢化物的还原性HX<H2Y<ZH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com