
【题目】下列有关金属及其合金的说法不正确的是 ( )
A. 目前我国流通的硬币是由合金材料制造的
B. 在钢中加入一定比例的Cr可防锈,不锈钢永远不会生锈
C. 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D. 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A. 98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B. 当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1,只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C. 只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D. 50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Fe2O3(s)+3C(石墨)![]() 2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol1①
2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol1①
CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH=283.0 kJ·mol1②
CO2(g) ΔH=283.0 kJ·mol1②
C(石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1③
CO2(g) ΔH=393.5 kJ·mol1③
则4Fe(s)+3O2(g)![]() 2Fe2O3(s)的ΔH为
2Fe2O3(s)的ΔH为
A.+1 164.1 kJ·mol1 B.1 641.0 kJ·mol1
C.259.7 kJ·mol1 D.519.4 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积一定的密闭容器中加入1 mol N2和3 mol H2发生反应:N2+ 3H2![]() 2NH3(正反应是放热反应)。下列有关说法正确的是
2NH3(正反应是放热反应)。下列有关说法正确的是
A. 达到化学反应限度时,可生成2mol NH3
B. 向容器中再加入N2,可以加快反应速率
C. 降低温度可以加快反应速率
D. 1mol N2和3mol H2的总能量低于2mol NH3的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计实验探究反应速率的测定和比较。
【实验目的】测定锌与稀硫酸反应的速率
【实验用品】锥形瓶、双孔塞、胶皮管、分液漏斗、直角导管、50mL注射器、铁架台、秒表、锌粒、1 mol/L硫酸、4 mol/L硫酸。
【实验步骤】
(1)取一套装置(如图所示),加入40 mL 1 mol/L的硫酸和锌粒,测量收集10 mL H2所需的时间。

(2)取另一套装置,加入40 mL4 mol/L的硫酸和锌粒,测量收集10 mL H2所需的时间。
【实验现象】锌与稀硫酸反应 (写现象),收集10mL气体,(2)所用时间比(1)所用时间_________。
【实验结果】
加入试剂 | 反应时间 | 反应速率 |
40 mL 1 mol/L硫酸 | 长 | _________ |
40 mL 4 mol/L硫酸 | 短 | _________ |
【实验结论】4 mol/L硫酸与锌反应比1 mol/L硫酸与锌反应的速率 。
【注意事项】(1)锌的颗粒(即表面积)大小 ;
(2)40 mL的硫酸要迅速加入;
(3)装置 ,且计时要迅速准确;
(4)气体收集可以用排水量气装置(如图所示)代替。

【实验讨论】除本实验测定反应速率的方法外,可行的方案还有(至少填两种):
(1) 。
(2) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】上海环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的办法,其中塑料袋、废纸、旧橡胶制品等属于
A.无机物 B.有机物 C.盐类 D.非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是____________(填序号)。
a.电解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
b.高温使水分解制氢:2H2O(g)![]() 2H2+O2
2H2+O2
c.太阳光催化分解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
d.天然气制氢:CH4+H2O(g)![]() CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示。
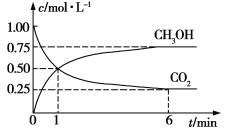
①从1 min到6 min,v(H2)=__________mol·L1·min1。
②能说明上述反应达到平衡状态的是_______(填编号)。
a.总压强保持不变
b.混合气体的密度不随时间的变化而变化
c.H2的体积分数在混合气体中保持不变
d.单位时间内消耗3 mol H2,同时生成1 mol H2O
e.反应中CO2与H2的物质的量之比为1∶3且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
(1)升高温度,反应速率将_________,平衡将如何移动 ;
(2)加入正催化剂,反应速率将_________,平衡将如何移动 ;
(3)充入更多的H2,反应速率将_________,平衡将如何移动 ;
(4)扩大容器的体积,反应速率将_________,平衡将如何移动 ;
(5)容器体积不变,通入氖气,反应速率将___________,平衡将如何移动 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com