
����Ŀ������ֻ�ܱ�����A��B��A������һ�������ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݡ���ʼʱ�������������зֱ��������ʵ���SO3���壬��ʹA��B�ݻ����(��ͼ��ʾ)������400�������·�����Ӧ:2SO2��O2![]() 2SO3��������������ȷ���ǣ� ��
2SO3��������������ȷ���ǣ� ��

A. �ﵽƽ������Ҫ��ʱ��:A��������
B. �ﵽƽ��ʱ:B������SO3��ת���ʸ���
C. �ﵽƽ��ʱ:A������SO2�����ʵ�������
D. �ﵽƽ������������зֱ�ͨ������ĺ�����A������SO3�������������
���𰸡�C
��������A����ʼʱ�������������зֱ��������ʵ���SO3���壬��Ӧ����������ʵ�������ķ����ƶ���A������һ�������ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݣ���A��ѹǿС��B��ѹǿ��ѹǿԽ��Ӧ����Խ����B�ﵽƽ������Ҫ��ʱ��̣�A����B��ѹǿ����ƽ��������SO3�ķ����ƶ���B������SO3��ת����С��B����C��A��ѹǿС��������SO2�����ɣ���ﵽƽ��ʱA������SO2�����ʵ������࣬C��ȷ��D���ﵽƽ������������зֱ�ͨ������ĺ�����A��������ѹǿ�仯���������������ƽ��������SO2�ķ����ƶ���A������SO3�����������С��B������䣬������ƽ��û��Ӱ�죬B������SO3������������䣬D����ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϸ������ֳơ���ɫ��Ⱦ��������Σ����
�����Էֽ⣬�ƻ������ṹ��Ӱ��ֲ����������Ⱦ�����Σ��������������� ���ƻ�������������Ⱦ����ˮ
A. �٢ڢۢ� B. �٢ۢ� C. �ڢۢ� D. �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ������������ͷ�Ӧ��������ȥ����B����ɫ��Ӧ�ʻ�ɫ��C��D��E��G�dz��������壬 C ��D��E�ǵ�����C�ʻ���ɫ��H��G�����Ԫ����ͬ��H��Ħ������Ϊ32g��mol��1��I�dz��������࣬J���Ϻ�ɫ�������ʡ�
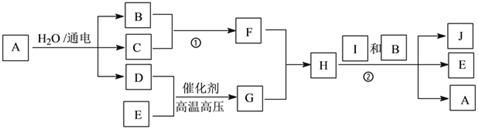
��1��D�Ļ�ѧʽΪ_____________________��
��2��G�ĵ���ʽΪ_____________________��
��3��д����Ӧ�ٵ����ӷ���ʽ��_____________________��
��4��д����Ӧ�ڵĻ�ѧ����ʽ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���мס���������ȫ��ͬ��װ�ã��ֱ������ǵIJ����װ��1.06g Na2CO3��0.84g NaHCO3���Թ��и���10mL��ͬŨ�ȵ����ᣨ��ͼ����ͬʱ����������е�����ȫ��������Ե��Թ��У�����������ȷ����
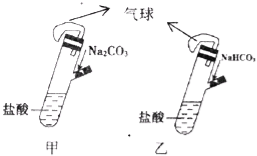
A. ��װ�õ������������ʴ�
B. �����������������ͬ����һ����c��HCl����2 mol/L
C. �����������������ͬ����һ����c��HCl����1 mol/L
D. ��������Һ��Na+��Cl�������ʵ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(DME)����Ϊ��21���͵����ȼ�������ɺϳ����Ʊ������ѵ���Ҫԭ�����£�
��CO(g)+2H2(g)![]() CH3OH(g)��H1=-90.7 kJ��mol-1
CH3OH(g)��H1=-90.7 kJ��mol-1
��2CH3OH(g)![]() CH3OCH3(g)+H2O(g)��H2=-23.5kJ��mol-1
CH3OCH3(g)+H2O(g)��H2=-23.5kJ��mol-1
��CO(g)+H2O(g)![]() CO2(g)+H2(g)��H3=-41.2 kJ��mol-1
CO2(g)+H2(g)��H3=-41.2 kJ��mol-1
�ش��������⣺
��1����Ӧ3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)����H=_____________kJ��mol-1��
CH3OCH3(g)+CO2(g)����H=_____________kJ��mol-1��
��2���ڲ�ͬ�¶��°�����ͬ���ʵ���Ͷ�Ϸ�����Ӧ�٣����CO��ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����_____________��

A����Ӧ�¶ȣ�T1>T2 B������Ӧ���ʣ�����(y)=����(w)
C����������ܶȣ���(x)>��(w) D���������ƽ��Ħ��������M(y)<M(z)
E���÷�Ӧ����S<0����H<0���������ڽϵ��¶����Է�����
��3������һ�����͵Ĵ���(��Ҫ�ɷ���Cu-Mn�ĺϽ�)������CO��H2�Ʊ�������(DME)����ͼ�ش�����;������![]() ԼΪ_____________ʱ�������ڶ����ѵĺϳɡ�
ԼΪ_____________ʱ�������ڶ����ѵĺϳɡ�

��4������ʱ�����ѷ����ֽⷴӦ��CH3OCH3![]() CH4+CO+H2��Ѹ�ٽ�����������һ��504���ij����յ�ƿ�У��ڲ�ͬʱ��t�ⶨƿ��ѹǿP�����±���
CH4+CO+H2��Ѹ�ٽ�����������һ��504���ij����յ�ƿ�У��ڲ�ͬʱ��t�ⶨƿ��ѹǿP�����±���
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
P��/kPa | 50.0 | 78.0 | 92.0 | 99.0 | 100 | 100 |
���÷�Ӧ��ƽ�ⳣ������ʽΪKp=_____________��
���÷�Ӧ��ƽ�ⳣ��Kp=_____________��(����λ��ijһ���ʵ�ƽ���ѹ=��ѹ�����ʵ�������)
��5��һ���Զ�������Ϊȼ�ϵ�ȼ�ϵ�صĹ���ԭ����ͼ��ʾ�����为���ĵ缫��ӦʽΪ_______________���õ�ص����������ѹΪ1.20V�����������ܶ�E=_____________(��ʽ���㡣�����ܶ�=����������/ȼ��������1kW��h=3.6��106J�������ڳ���F=96500C��mol-1)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ŀ��X��Y��Z��W��R��M����Ԫ�أ�λ��Ԫ�����ڱ���ǰ�����ڣ����ǵĺ˵�����������������Ϣ���£�
Ԫ�� | �����Ϣ |
X | �䵥��Ϊ���壬�����缫���� |
Y | ԭ�Ӻ�����6�ֲ�ͬ�˶�״̬�ĵ��� |
Z | �ǽ���Ԫ�أ���̬ԭ�ӵ�s����ĵ���������p����ĵ���������ͬ |
W | ����Ԫ�أ���Zԭ�ӵļ۵�������ͬ |
R | �۲�����Ų�Ϊ3d64s2 |
M | ��B�壬�䵥�ʳ��������� |
��ش���������(����ʱ��X��Y��Z��W��R��M������Ӧ��Ԫ�ط��ű�ʾ)��
��1��X�ĵ�����Z�ĵ��ʷ�Ӧ�IJ���Ϊ_____________��(�ѧʽ)��
��2��Z��W��ȣ���һ�����ܽϴ����_____________��M2+�ĺ�������Ų�ʽΪ_____________��
��3��M2Z���۵��M2W��_____________(����������������)�������ԭ��______________________��
��4��Y��Z�γɵĻ�����YZ2��VSEPRģ��Ϊ__________������Yԭ�����ӻ��������Ϊ____________;N3-��YZ2��Ϊ�ȵ����壬��N3-�ĽṹʽΪ_____________��
��5��MRW2�ľ�����ͼ��ʾ����������a=0.524nm,c=1.032nm;MRW2�ľ�����ÿ��Mԭ����_________��Wԭ�������������ܶ���=________g��cm-3(ֻҪ������ʽ�����ؼ������ֵ��NA=6.02��1023mol-1)��
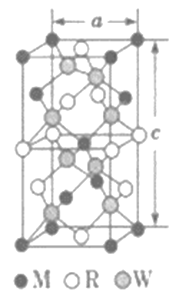
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.01 mol��L-1 �Ĵ�����Һ�е���pH=7 �Ĵ������Һ����ҺpH �����������Һ����仯������ʾ��ͼ��ͼ��ʾ�����з�����ȷ����

A. a �㣬pH = 2
B. b �㣬c(CH3COO-) > c(NH4+)
C. c �㣬pH ���ܴ��� 7
D. ac �Σ���ҺpH ������CH3COOH �ܴ���淋�Ӱ������ٵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����C8H10��C3H6Ϊԭ�������л����� PMMA �ĵ��壬ͬʱ�����Եõ��߷��Ӳ��� PET �۷���֬�ĵ��塣 �ϳ�·�����������ַ�Ӧ������������ȥ����
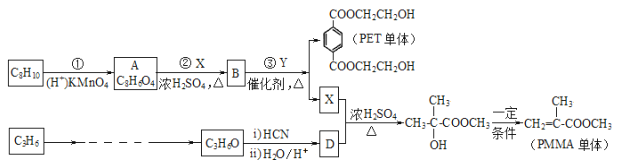
��֪�� I��RCOOR��+R��OH![]() RCOOR��+R��OH��R��R����R��������������
RCOOR��+R��OH��R��R����R��������������
II��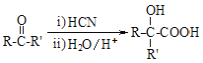
��ش��������⣺
��1�������� A �Ĺ���������__________�� ���ķ�Ӧ����_____________��
��2����Ӧ���Ļ�ѧ����ʽ_______________________________��
��3��д����������Ҫ������ PMMA ���廥Ϊͬ���칹�������ͬ���칹��Ľṹ��ʽ��___________��
��������ף�IR��֤�����ӽṹ����̼̼˫����
��1H �˴Ź����ף�1H-NMR����ʾ�����ֲ�ͬ����ԭ�ӡ�
������̼�����Ʒ�Ӧ�������壻
��4��Y �Ľṹ��ʽ_________________��
��5��д�� C3H6 �� C3H6O �ĺϳ�·�ߣ��Լ����ܼ���ѡ���ϳ�·�߲�������֪ II���е���д��ʽ��
_______________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com