
【题目】在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( ) 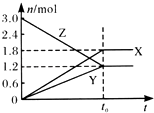
A.该反应的化学方程式为:3Z═3X+2Y
B.t0时,X、Y、Z的质量不再改变
C.t0时,Z的浓度为1.2 mol/L
D.t0时,反应停止,反应速率为0
【答案】B
【解析】解:A、由图可知,X、Y的物质的量增大,为生成物,Z物质的量减小,为反应物,到平衡后,X生成1.8mol,Y生成1.2mol,Z反应1.8mol,X、Y、Z的化学计量数之比=1.8:1.2:1.8=3:2:3,则反应的化学方程式为:3Z3X+2Y,是可逆反应,故A错误; B、化学平衡时各组分的浓度不再随时间变化而变化,故X、Y、Z的质量也不再改变,故B正确;
C、根据图像可知平衡时Z的浓度为 ![]() =0.6mol/L,故C错误;
=0.6mol/L,故C错误;
D、根据可逆反应平衡的特征可知,反应处于平衡时正逆反应速率相等,但不等于零,故D错误;
故选B.
【考点精析】关于本题考查的化学平衡状态本质及特征,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能得出正确答案.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】已知:(X代表卤素原子,R代表烃基) 
利用上述信息,按以下步骤从 ![]() 合成
合成 ![]() .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)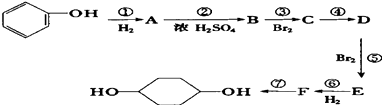
请回答下列问题:
(1)分别写出B、D的结构简式:B、D .
(2)反应①~⑦中属于消去反应的是 . (填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为: .
(4)试写出C→D反应的化学方程式(有机物写结构简式,并注明反应条件): .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把下列物质分别加入装有水的锥形瓶里,立即塞紧带有U形管的塞子,已知U形管内预先装有少量水(为方便观察,预先将水染成红色),结果U形管左边液面升高,则加入的物质可能是( ) 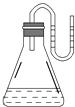
A.NaOH固体
B.浓硫酸
C.NH4NO3晶体
D.Na2O2固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 同温同压下,相同体积的物质,其物质的量一定相等
B. 任何条件下,等物质的量的CH4和CO所含的分子数一定相等
C. 1LCO气体一定比1LO2的质量小
D. 等体积的CO气体和N2,它们的质量也一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述正确的是( )
A.铜一锌原电池中,铜是负极
B.用电解法精炼粗铜时,粗铜作阴极
C.在镀件上电镀铜时,用金属铜作阳极
D.电解稀硫酸制H2、O2时,铜作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( ) 
A.x是强碱,y是弱碱
B.若x、y是一元碱,则等物质的量浓度的x的硝酸盐溶液的pH比y的硝酸盐溶液大
C.若x、y是一元碱,室温下pH=11的x、y两种碱溶液的浓度相同
D.完全中和x、y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化.请回答下列问题: 
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是热反应,Ba(OH)28H2O与NH4Cl的反应是热反应.反应过程(填“①”或“②”)的能量变化可用图2表示.
(2)现有如下两个反应: (A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Cu=2FeCl2+CuCl2
以上两个反应能设计成原电池的是 , 负极材料为: , 电解质溶液为: , 负极的电极反应式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用沉淀法测定Na2SO3和NaCl固体混合物中Na2SO3的质量分数.操作流程如下: 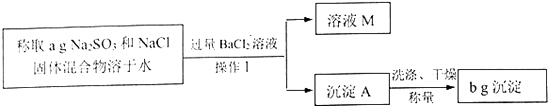
(1)操作I所用到的玻璃仪器有烧杯、玻璃棒、 .
(2)操作I之前,为判断所加BaCl2溶液是否过量,设计如下方案,其中最合理的是 .
A.取少量上层清液,继续滴加稀H2SO4 , 若沉淀产生则说明BaCl2已过量
B.待浊液澄清后,继续滴加BaCl2溶液,若无沉淀产生则说明BaCl2已过量
C.待浊液澄清后,继续滴加稀H2SO4 , 若沉淀产生则说明BaCl2已过量
(3)根据操作流程中的数据计算Na2SO3的质量分数 .
(4)该同学认真分析,上述实验操作均正确,但发现实验结果与预期相差较大,请你推测可能的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两化学兴趣小组安装两套如图1相同装置,用以探究影响H2O2分解速率的因素. 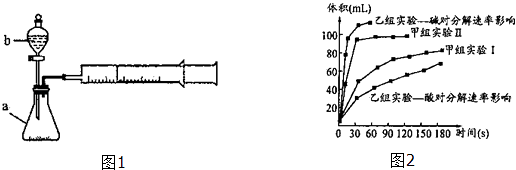
(1)仪器b的名称: .
(2)甲小组有如下实验设计方案,请帮助完成下列填空.
实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
甲组实验Ⅰ | 做实验参照 | 25 | 10mL 2%H2O2 | |
甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10mL 5%H2O2 |
(3)甲、乙两小组得出如图2数据. ①由甲组实验得出的数据可知:浓度越大,H2O2分解速率(填“越快”、“越慢”);
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是;
③乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2 , 其化学反应方程式为;支持这一方案的理由是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com