
【题目】原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36,Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子。回答下列问题:
(1)已知化合物XZ3与H2Y(Y的氢化物)发生反应的化学方程式为XZ3+H2Y→XH3+HZY,则元素的电负性:Y______Z(填“大于”或“小于”),化合物HZY分子的空间构型为______。
(2)X的一种氢化物的相对分子质量为32,1mol该氢化物中的σ键数是______。
(3)①元素Y的一种单质分子与元素X、Y形成的一种离子互为等电子体,这两种微粒的化学式是_______、________。
②基态W原子的电子排布式是_______________。
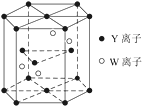
(4)元素Y和W的一种化合物的晶体结构如图所示,该晶体的化学式为______;金属原子______(选填“钾”、“镁”、“铜”)形成的晶体的堆积方式,与上述晶胞中Y离子的堆积方式相同。
【答案】大于 V形 5NA O3 NO2- 1s22s22p63s23p63d54s1或[Ar]3d54s1 Cr2O3 镁
【解析】
原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36,Y基态原子最外层电子数是其内层电子总数的3倍,则Y为O元素;X、W基态原子是同周期元素中未成对电子数最多的原子,X原子序数比氧小,则X在第二周期为N元素;则W为第三周期的P或第四周期的Cr;已知X与Z的原子核内质子数之和等于W原子核内质子数,若W为P,则Z为O,与Y相同,所以不符合题意,若W为Cr,则Z为Cl,而且Cl的基态原子只有1个未成对的电子,符合题意,据此分析解答。
根据上述分析可知,X为N元素,Y为O元素,Z为Cl元素,W为Cr元素。
(1)化合物NCl 3与H2O发生反应的化学方程式为NCl 3+H2O→NH3+HClO,反应产物HClO中O元素为-2价,Cl元素为+1价,即O的得电子能力更强,所以电负性O大于Cl,HClO的结构为H-O-Cl,与H2O的H-O-H相似,是V形,故答案为:大于; V形;
(2)N的一种氢化物常见的有NH3和N2H4,相对分子质量为32的是N2H4,其结构式为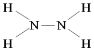 ,分子中含有5个σ键,所以1mol该氢化物中的σ键数是5NA,故答案为:5NA;
,分子中含有5个σ键,所以1mol该氢化物中的σ键数是5NA,故答案为:5NA;
(3)①元素O的一种单质分子与元素N、O形成的一种离子互为等电子体,O3 和NO2-的原子数和价电子数相同,互为等电子体,故答案为:O3 和NO2-;
②W为Cr元素,原子核外有24个电子,所以基态原子的电子排布式为1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1或[Ar]3d54s1;
(4)由图可知,Cr离子位于晶胞内部,有4个,O2-位于上下面的面心和顶点,以及晶胞内部,所以O2-共有![]() ×2+
×2+![]() ×12+3=6个,则Cr与O的离子数之比为2∶3,所以该晶体的化学式为Cr2O3;由图可知,该晶胞为六方最密堆积,与Mg晶体的堆积方式相同,故答案为:Cr2O3;镁。
×12+3=6个,则Cr与O的离子数之比为2∶3,所以该晶体的化学式为Cr2O3;由图可知,该晶胞为六方最密堆积,与Mg晶体的堆积方式相同,故答案为:Cr2O3;镁。


科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,结构如图所示,下列有关叙述中正确的是

A.该有机物易溶于水
B.可以与Na2CO3生成2molCO2
C.该分子对称性好,所以没有顺反异构
D.该有机物分子中,最多可能有18个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的一部分,参照①~⑧元素在表中的位置,请用化学用语回答下列问题:
周期/主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)④、⑤、⑧三种元素中,离子半径大小的顺序为__________(填离子符号)。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_________(填化学式)。
(3)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为:_____________。
(4)能说明⑧的非金属性比⑨的非金属性_________(填“强”或“弱”)的事实是____________________________(用离子方程式说明)。
(5)①和③形成的18电子的化合物甲是一种应用广泛的化工原料,写出甲的电子式:_________,实验室中可用次氯酸钠溶液与氨反应制备甲,反应的化学方程式为:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7% O2:11% N2:82%)。
| 0.1个大气压 | 0.5个大气压 | 1个大气压 | 10个大气压 |
400 | 99.2 | 99.6 | 99.7 | 99.9 |
500 | 93.5 | 96.9 | 97.8 | 99.3 |
600 | 73.7 | 85.8 | 89.5 | 96.4 |
(1)SO2的氧化反应是___反应(填“吸热”或“放热”)。
(2)根据图中所给信息,你认为工业上将SO2转化为SO3的适宜条件是___。
(3)选择适宜的催化剂,是否可以提高SO2的转化率?___(填“是”或“否”)。
(4)若保持温度和容积不变,平衡后通入氧气,再达平衡时则SO2浓度___。(填“增大”或“减小”)
(5)若保持温度和压强不变,平衡后通入He气,SO3的含量___。(填“增大”或“减小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积Kw | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”“<”或“=”)。
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1 mL加水稀释至10mL,则稀释后溶液中c(Na+)∶c(OH-)=__。
(3)在t2℃下pH=10的NaOH溶液中,水电离产生的OH-浓度c(OH-)水=__。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KIO3与H2S反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得KIO3;③打开K,通入H2S直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出H2S;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
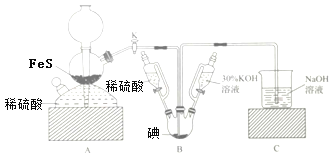
A.步骤②可观察到固体溶解,溶液由棕黄色变为无色
B.步骤③装置B中发生反应的离子方程式为3H2S+IO3-═3S↓+3H2O+I-
C.装置C中氢氧化钠溶液的作用是吸收硫化氢
D.步骤⑤中一系列操作为过滤,洗涤,合并滤液和洗液,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题
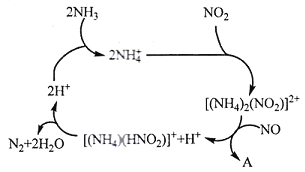
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如下图所示。A包含物质为H2O和___________(填化学式)
(2)已知:4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
H2O(l)=H2O(g) △H3=+c kJ/mol
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=___________ kJ/mol
(3)工业上利用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)![]() HCN(g)+3H2(g ) △H>0
HCN(g)+3H2(g ) △H>0
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图甲所示。则X可以是___________(填字母序号)
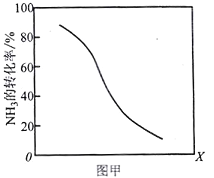
a.温度 b.压强 c.催化剂 d.![]()
②在一定温度下,向2L密闭容器中加入 n mol CH4和2 moI NH3,平衡时NH3体积分数随n变化的关系如图乙所示。
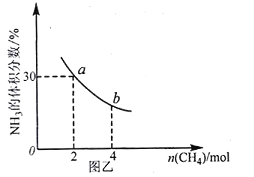
a点时,CH4的转化率为___________%;平衡常数:K(a)_____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为: Mb(ag)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为:
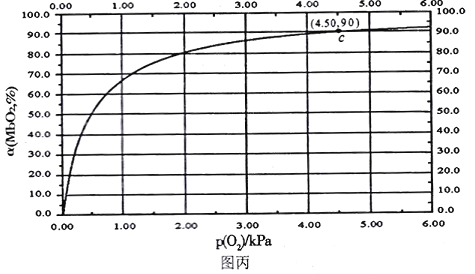
MbO2(aq),该反应的平衡常数可表示为:![]() 。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[
。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[![]() ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
①试写出平衡常数K与速率常数k正、k逆之间的关系式为K=___________(用含有k正、k逆的式子表示)。
②试求出图丙中c点时,上述反应的平衡常数K=___________kPa-1。已知k逆=60s-1,则速率常数k正=___________s-1·kPa-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、足量的CuSO4溶液和足量的 K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加6.4g。以下说法不正确的是:
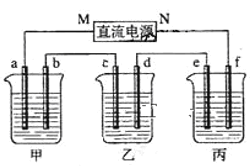
A.电源的N端为正极
B.电极b上发生的电极反应为4OH--4e-=2H2O+O2↑
C.b电极上生成气体1.12L,e电极上生成气体0.2 g
D.如果电解过程中铜全部析出,此时电解继续进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾(KAl(SO4)2·12H2O)。由明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
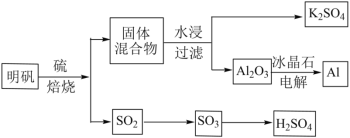
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比为_______。
(2)从水浸后的滤液中得到K2SO4晶体的操作方法是_______。
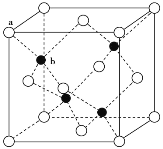
(3)A12O3在一定条件下可制得AIN,AlN的晶体结构与金刚石相似,晶胞结构如图所示。每个晶胞中含有_______个铝原子,若Al与N原子最近距离为apm,则该晶体的密度为_______g/cm3。(阿伏加德罗常数用NA表示)
(4)SO2分子的空间构型为_______
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时
2SO2(g)+O2(g)![]() 2SO3(g)△H1=一197kJ/mol;
2SO3(g)△H1=一197kJ/mol;
2H2O(g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com